脳腫瘍グレードⅣの膠芽腫治療に光射す 標準治療に自家腫瘍ワクチン療法を加えて生存期間延長を目指す

脳腫瘍の中で最難治と言われる膠芽腫(こうがしゅ)に、新たな治療法が確立されつつある。第Ⅱ相臨床試験を突破し、これから第Ⅲ相試験に挑む自家腫瘍ワクチン療法だ。2004年から16年間、東京女子医科大学と筑波大学による共同研究でデータを積み上げてきたという。膠芽腫治療においてジワジワと成果を上げてきた自家腫瘍ワクチン療法とはいったいどんな治療法なのだろうか。東京女子医科大学先端生命医科学研究所副所長の村垣善浩さんに話を聞いた。
脳腫瘍の中で最も悪性度が高い膠芽腫
脳腫瘍は、悪性度の段階をグレードⅠからⅣまで4段階に分けて分類する。グレードⅠは良性腫瘍なので、手術ですべてを摘出できれば再発の恐れはほとんどない。髄膜種(ずいまくしゅ:ごく少数にグレードⅡ、Ⅲも)、下垂体腺腫、神経鞘腫(しんけいしょうしゅ)、頭蓋咽頭腫(とうがいいんとうしゅ)などがこれに当たる。
グレードⅡ~Ⅳが悪性腫瘍だ。中でも神経膠腫(しんけいこうしゅ:グリオーマ)の頻度が高く、年間約5,000人が新たにグリオーマと診断される。グリオーマはさらに細分化され、その中で最も悪性度が高いのがグレードⅣの膠芽腫(こうがしゅ:グリオブラストーマ)。膠芽腫の現在の標準治療は「手術+放射線治療+抗がん薬テモダール(一般名テモゾロミド)」である。
「膠芽腫は脳腫瘍の中で最も手ごわく、術後の生存期間、1年生存率ともに厳しいのが現状です。かつ、過去に幾つもの治療法が臨床試験を突破できず、膠芽腫の標準治療は長年、『手術+放射線治療』のみでした。そんな中、10数年前の2006年に、ようやく抗がん薬テモダールが第Ⅲ相試験を突破し、承認されて標準治療に追加されたのです」と東京女子医科大学先端生命医科学研究所副所長の村垣善浩さんは、膠芽腫治療法の変遷について語った。
14年前にテモダールが標準治療に追加されたことで、それ以前に比べると確かに治療成績は上がった。とはいえ、やはり難治であることに変わりはない。依然として膠芽腫は「最も手ごわい脳腫瘍」なのだ。
自家腫瘍ワクチン療法のメカニズムとは
膠芽腫に対し、東京女子医科大学先端生命医科学研究所の村垣善浩さん、丸山隆志さんと筑波大学脳神経外科学准教授の石川栄一さんらが中心となって長年取り組んできた治療法がある。それが自家腫瘍ワクチン療法だ。2004年の開始から16年を経た今、期待される効果を最終確認する段階になってきた。現在、第Ⅱ相試験を終了し、医師主導治験の第Ⅲ相試験が始まるところだという。
自家腫瘍ワクチン療法とは、一言で言うと「患者自身の腫瘍成分を抽出して加工し、ワクチンとして体内に戻す」治療法。ワクチンが体内のリンパ球に腫瘍の目印(抗原)を教え、抗原を認識したリンパ球が腫瘍を見極め、攻撃してくれるという機序(メカニズム)を持つ。
「ワクチン療法は他にも複数ありますが、それらは腫瘍の多くが持つ1~4つの抗原をワクチンにしています。ところが、腫瘍は1つひとつ、それぞれに個性があり、持っている抗原が違うだけでなく、1つの腫瘍が多数の抗原を持っているのです。その中に、ワクチン療法がターゲットにした抗原が入っていなかったり、たとえ入っていても割合が少なかったりすると、効果がないことも大いに考えられるわけです」と村垣さんは一般的なワクチン療法について語り、自家腫瘍ワクチン療法と他のワクチン療法の違いについてこう続けた。
「自家腫瘍ワクチン療法では、手術時に採取してホルマリン固定された腫瘍組織そのものを使ってワクチンを作るので、その患者さんの腫瘍が持つほぼすべての抗原がワクチンの中に入っています。究極の個別化ワクチンと言っても良いでしょう。これが、他のワクチン療法との明らかな違いです」
手術時にホルマリン固定された腫瘍組織は、採取後1~2年経っていても、手を加えてワクチンにして体内(皮膚内)に戻すことで、体内のリンパ球に腫瘍組織が持つ多くの抗原を教えることができるそうだ。ワクチンが体内に入ると、まず白血球の中の免疫細胞の1つである樹状細胞がワクチンを取り込み、「こいつが腫瘍の抗原だよ」とリンパ球に教える。そして、腫瘍の目印を教えられたリンパ球が、実際に病巣まで行って腫瘍細胞を叩くのだ(図1)。
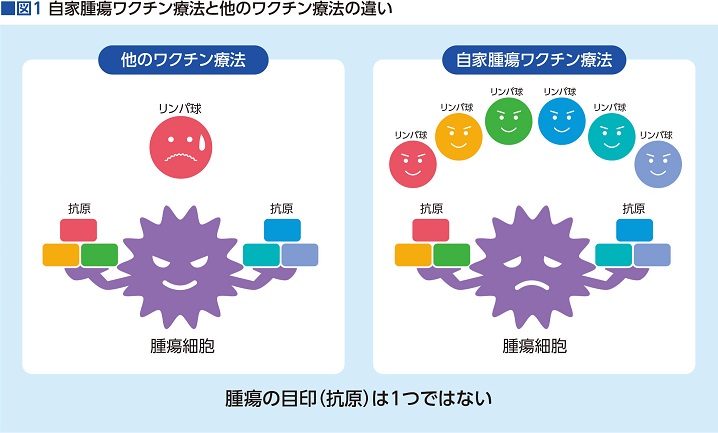
術後、時間が経っていても腫瘍組織さえあれば
ところで、ホルマリン固定した腫瘍組織とは、どうすれば手に入るのだろうか?
「部位を問わず、手術で腫瘍を切除したら、その後の組織検査や遺伝子検査のため、または組織を顕微鏡で見たりするために、ほとんどの施設で、切除した腫瘍をホルマリンに漬けて固定します。ですから、手術で採取した通常の組織を一部分けてください、というだけのことなのです。ただ、切除した腫瘍組織が小さすぎるとワクチンが作れないので、手術時にある程度しっかりした分量を切除していることが必須。小指の第2関節から先ぐらいの分量があれば自家腫瘍ワクチンを作成することができます」
始めから自家腫瘍ワクチン療法を行うと決めていれば、手術直後にホルマリン固定された腫瘍組織を分けてもらうことはたやすい。しかし、術後の治療を続ける中で、まだできることはないかと方法を探して自家腫瘍ワクチン療法にたどり着くケースがほとんどだろう。
「術後しばらく時間が経っていても、ホルマリン固定、もしくはパラフィン包埋(ほうまい)された腫瘍組織が規定量あれば、自家腫瘍ワクチン療法は受けられます」と村垣さん。もちろん術後早いほうがよいが、たとえ1~2年経過していても、手術時に腫瘍をある程度の塊で採取できてさえいれば、小指の第2関節から先ほどの腫瘍サンプルは分けてもらえる可能性は高い。今は、サンプルさえ残っていれば、手術した病院に手続きすれば、まず出してもらえるそうだ。
術後補助療法としての役割と確かな効果
ところで、2004年から行っている自家腫瘍ワクチン療法、現在はどこまで進み、どのような成果が出ているのだろうか。
前述の通り、現在は第Ⅱ相臨床試験を終えたところだ。積極的に腫瘍を摘出された患者さんでの効果が期待されるため、近々、医師主導治験である第Ⅲ相試験に進む。
2004年に臨床試験を開始した時点での膠芽腫の標準治療は「手術+放射線治療」だったが、2006年にテモダールが加わった。自家腫瘍ワクチン療法は、この標準治療に追加して行うことになる。つまり、治療法として標準治療からマイナスするものはなく、「プラスする」という考え方だ。言い換えれば、術後補助療法の1つと捉えられる。
ちなみに、臨床試験開始直後はテモダールが標準治療になっていない時代だったため、テモダールなしでの臨床試験も行われたそうだ。
「化学療法は免疫療法の効果を低下させることもあり得るので、化学療法とワクチンを併用すると効果が縮小される可能性も考えなくてはなりませんでした。そこで当時は、テモダールありとテモダールなしの両面からアプローチしました。その結果、テモダールを入れたほうがよい結果が出たのです」
その結果を受けて、自家腫瘍ワクチン療法は「手術+放射線治療+テモダール」に加えられる形になったという。
ここで、東京女子医科大学における具体的な実績を比較してみよう。
まずは2000年から2014年までの生検例を含む膠芽腫全270症例についてのデータを見ると、全生存期間(OS)中央値は18.2カ月、1年生存率71%、3年生存率26%となっている。
その中で、2006年にテモダールが保険適用されて以降の標準治療「手術+放射線治療+テモダール」185症例における数値は、全生存期間中央値21.9カ月、1年生存率75%、3年生存率31%と、テモダールの効果を示している。さらに標準治療に自家腫瘍ワクチン療法を加えた2004年から2014年の数値は、全生存期間中央値31.3カ月、1年生存率64%、3年生存率46%という結果を出している(図2)。

まず明確なのは、膠芽腫はいまだ非常に難治であるということ。しかし、少しずつではあるが、治療法の進化とともにその数値は着実に上がってきているということだ。加えて、標準治療である「手術+放射線治療+テモダール」に自家腫瘍ワクチン療法をプラスすることで、若干ではあるが、確実に成果を見せていると言えるだろう。
「実際に患者さんに自家腫瘍ワクチン療法を行い、その後をフォローしている医師たちに話を聞くと、やはり手応えを感じると言います。劇的に効果があるという治療法ではないけれども、ジワジワと効くタイプの治療のようです」と村垣さんは説明する。
さらに補足すると、東京女子医大では2009年から手術時に光線力学的療法(photodynamic therapy :PDT)が導入され、2014年には保険適用になったことで、手術成績の向上が期待されている。それによる実績アップが伴っていることも付記したい。
同じカテゴリーの最新記事
- 悪性脳腫瘍に対する緩和ケアの現状とACP 国内での変化と海外比較から考える
- ウイルス療法が脳腫瘍で最も悪性の膠芽腫で高い治療効果! 一刻も早いウイルス製薬の量産化技術確立を
- 手術技術、化学療法、遺伝子診断、そしてチーム医療が重要 治療成績が向上する小児脳腫瘍
- 他のがん種よりも早期介入が必要 目を逸らさずに知っておきたい悪性脳腫瘍の緩和・終末期ケア
- 標準治療では治癒が難しい悪性脳腫瘍の治療に光明が ホウ素中性子捕捉療法「BNCT」の実用化が見えてきた
- 光の力でがん細胞を叩く治療 悪性脳腫瘍に光線力学的療法(PDT)併用の実力
- 新たにウイルス療法や免疫チェックポイント阻害薬など 悪性度の高い膠芽腫などの脳腫瘍治療に見えてきた可能性
- 脳転移治療にはガンマナイフが効果的 さらに患者にやさしい新型登場
- 転移性脳腫瘍に対するガンマナイフの有効性と安全性



