ASCO乳がんシンポジウム2014 リポート
新時代の免疫療法成功のためにはチーム医療での取り組みが重要

前号に続き昨年(2014年)9月に米国サンフランシスコで開催された米国臨床腫瘍学会乳癌シンポジウム(ASCO Breast Cancer Symposium)から、今号では、メラノーマ(悪性黒色腫)の治療成績を飛躍的に改善した新たな免疫療法である〝免疫チェックポイント阻害〟について、乳がん治療でも成功させるための戦略に関する講演を紹介する
乳がんでも免疫系は重要な役割
免疫チェックポイント阻害薬の1つ*CTLA-4阻害薬は、いくつかの固形がんでも効果や安全性が検討された。米メモリアル・スローン・ケタリングがんセンター(ニューヨーク)のHeather L. McArthur氏によれば、「乳がんでは重大な副作用はなかったが腫瘍縮小例はみられず、42%で腫瘍増大が止まったという結果で、『ホームランではなかった』。しかし、最近の研究では、乳がんでも免疫系が重要な役割を果たしていることが示されている」という。
Geparsixto試験ではトリプルネガティブ(TN)とHER2陽性(HER2+)乳がんで、またFinHER試験ではHER2+乳がんで、腫瘍組織に腫瘍浸潤リンパ球(Tumor infiltrating lymphocyte: TILs)が多い患者ほど治療効果が高かった。
「腫瘍浸潤リンパ球が多い」ということは、腫瘍を異物として認識して、リンパ球が腫瘍組織内に多く集積してきている状態だと考えることができる。また、腫瘍組織周囲の免疫系の状態(免疫微小環境)をみると、免疫抑制に働くCTLA-4や*PD-1の遺伝子が多く発現しており、腫瘍が免疫から逃れようとしている状態にあったことが観察された。さらに、*ハーセプチンの効果が高かった患者は腫瘍浸潤リンパ球高値で、ハーセプチンが免疫微小環境を改善する可能性も示唆された。
*CTLA-4(cytotoxic T-lymphocyte-associated protein 4:細胞傷害性Tリンパ球抗原4)=T細胞の表面に発現し、T細胞の活性を抑制することで自己免疫機能を抑える分子 *PD-1(Programmed cell death 1)=細胞死誘導時に発現が増強されるタンパク質 *ハーセプチン=一般名トラスツズマブ
免疫系が働きやすい環境を作る
McArthur氏らは、ハーセプチンと同様に免疫微小環境を改善する方法として、腫瘍を超低温で凍らせてバラバラにして死滅させる〝凍結融解壊死治療〟(cryoablation)を試みた。「免疫系が腫瘍を食べやすくする」、つまり抗原提示細胞が腫瘍の断片を提示しやすくするのが目的だ。
CTLA-4阻害薬*ipilimumab(イピリムマブ)に併用すると腫瘍縮小効果が上がることを動物実験で確認した後、乳がん患者での安全性と免疫反応を調べるパイロット試験を行った。結果は、共同研究者のDavid B. Page氏がポスターセッションで発表した。
対象は18歳以上、1.5cm以上の手術可能病変を有し、乳房切除術を予定している患者で、自己免疫疾患、免疫抑制薬あるいはステロイド服薬中の患者は除外した。サブタイプ別では、TNおよびHER2+乳がんの腫瘍で、治療前のT細胞密度が高くなっていた。
ただ、ホルモン受容体陽性(ER+)でも腫瘍のT細胞密度が高い患者はいて、ER+でも免疫療法が効くような腫瘍が存在することが示唆された。
治療別では凍結融解壊死治療、ipilimumabの単独群と比較して、凍結融解壊死治療+ipilimumab併用群で増殖能の高いT細胞が増えていることや、T細胞がより活性化していることが示された。
*ipilimumab(イピリムマブ)=米国での販売名YERVOY
成功のためには多職種の協力が不可欠
McArthur氏は、免疫チェックポイント阻害という新たな免疫療法について、メラノーマや固形がんにおいて成功していること、乳がんで腫瘍浸潤リンパ球が治療予後や治療反応性の予測因子になることが示唆されていること、ハーセプチンや凍結融解壊死治療など免疫環境を改善する方法があることがわかってきたことなどから、「乳がんにおいても成功させることが可能」との考えを示した。
また、画像で腫瘍を確認しながら行う凍結融解壊死治療では放射線医の協力が欠かせないことに触れ、「実現のためには腫瘍内科医だけでなく、外科医や放射線腫瘍医など他の職種、そして患者とともに取り組む必要がある」として、通常の乳がん治療以上にチーム医療が重要であることを指摘した。
自己を攻撃しない仕組み「免疫チェックポイント」を腫瘍が利用
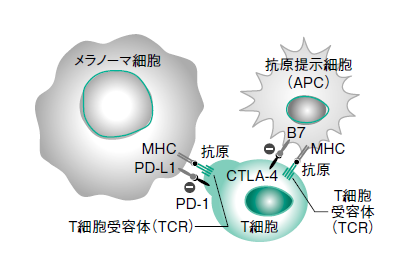
T細胞は、2つのシグナルを受け取って初めて活性化して機能する。抗原提示細胞(APC)は異物の断片を取り込んで分解し、*MHC分子を介して、その一部を抗原(異物の目印)として細胞表面上に提示する。これをT細胞受容体(TCR)が認識して第1シグナルとして細胞内に伝達すると、T細胞は「出動体制」となる(図)。
しかし〝共刺激〟と呼ばれる第2シグナルなしには、活性化の維持や、特別な機能を持つT細胞(異物を殺す細胞傷害性T細胞や、ほかの免疫細胞の働きを助けるヘルパーT細胞など)への分化ができず、細胞死や不応答を起こす。
第2シグナルを伝えるのは補助刺激受容体だが、CTLA-4やPD-1のように活性化を抑制する負の補助刺激受容体もある。これらは自分自身を攻撃しないように自己応答を制御するなど、過剰な免疫反応を抑制するチェックポイントとして、免疫系全体のバランス調節に寄与している。
腫瘍の多くは、免疫系によって「異物」として早期に除去されるが、腫瘍細胞は悪賢い。様々な機序を利用して生き延びようとする。PD-1のリガンド(PD-1と特異的に結合する物質)である*PD-L1を発現して「異物ではないふり」をするのもその1つだ。
*MHC分子=主要組織適合遺伝子複合体抗原 *PD-L1(programmed cell death 1 ligand-1)=T細胞に発現しているPD-1のリガンド。PD-L1がT細胞上のPD-1受容体と結合すると、T細胞の活性が抑制される
同じカテゴリーの最新記事
- 高濃度乳房の多い日本人女性には マンモグラフィとエコーの「公正」な乳がん検診を!
- がん情報を理解できるパートナーを見つけて最良の治療選択を! がん・薬剤情報を得るためのリテラシー
- 〝切らない乳がん治療〟がついに現実! 早期乳がんのラジオ波焼灼療法が来春、保険適用へ
- 新規薬剤の登場でこれまでのサブタイプ別治療が劇的変化! 乳がん薬物療法の最新基礎知識
- 心臓を避ける照射DIBH、体表を光でスキャンし正確に照射SGRT 乳がんの放射線治療の最新技術!
- 術前、術後治療も転移・再発治療も新薬の登場で激変中! 新薬が起こす乳がん治療のパラダイムシフト
- 主な改訂ポイントを押さえておこう! 「乳癌診療ガイドライン」4年ぶりの改訂
- ステージⅣ乳がん原発巣を手術したほうがいい人としないほうがいい人 日本の臨床試験「JCOG1017試験」に世界が注目!
- 乳がん手術の最新情報 乳房温存手術、乳房再建手術から予防的切除手術まで
- もっとガイドラインを上手に使いこなそう! 『患者さんのための乳がん診療ガイドライン』はより患者目線に



