- ホーム >
- 薬 >
- 免疫チェックポイント阻害薬
免疫チェックポイント阻害薬で完治の可能性も 腎がん薬物療法の主役は、分子標的薬から免疫チェックポイント阻害薬へ

転移性腎がん・切除不能腎がんへの免疫チェックポイント阻害薬オプジーボ(一般名ニボルマブ)承認から3年。臨床試験による経過追跡は4年を超え、動向が見えてきた。2次治療でのオプジーボ単独に加え、1次治療での免疫チェックポイント阻害薬同士の併用療法、さらには免疫チェックポイント阻害薬と分子標的薬の併用療法も動き出した今、最新状況を聞いた。
分子標的薬が主役の時代
進行・再発転移によって手術が不可能な場合、一般的には、抗がん薬による化学療法が検討されることが多い。ところが、腎がん(腎細胞がん)はもともと抗がん薬の感受性が低いため、化学療法が選択されてこなかったという背景がある。
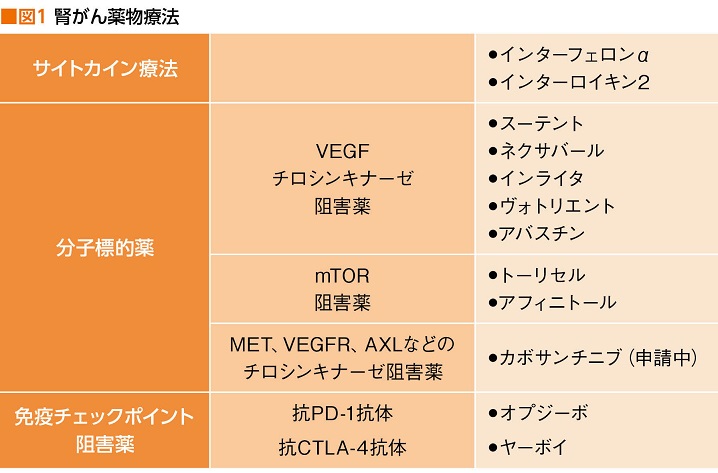
化学療法の代わりに腎がんに行われてきた薬物療法が、サイトカイン療法。インターフェロンα(IFN-α)とインターロイキン2(IL-2)の2剤が承認されているが、その成績は決して芳しいものではなく、2008年のネクサバール(一般名ソラフェニブ)とスーテント(一般名スニチニブ)承認に始まる分子標的薬の登場を機に、腎がんの薬物療法の主役は分子標的薬へと移り変わっていった。
腎がんにおける分子標的薬の中心は、血管新生阻害薬。がん組織内の血管新生を阻害し、がん細胞を兵糧攻めにすることでがん細胞の自己死(アポトーシス)を促すという機序を持つ。チロシンキナーゼ阻害薬(血管内皮増殖因子受容体チロシンキナーゼ阻害薬:VEGFR-TKI)のネクサバールとスーテントの承認を皮切りに、2012年にインライタ(一般名アキシチニブ)、2014年にはヴォトリエント(一般名パゾパニブ)も加わった。
さらに、がんの増殖に関する因子を阻害するmTOR(エムトール)阻害薬のトーリセル(一般名テムシロリムス)とアフィニトール(一般名エベロリムス)も2010年に認可されており、合計6剤で今日まで腎がんの薬物療法を牽引してきた(図1)。
転移性腎がんでも、可能ならば局所治療を!
しかし、「腎がんの場合、進行がん、または転移がんだからといって、直ちに薬物療法を行うことは決して正解とは言えません」と日本医科大学泌尿器科学教室准教授の木村剛さんは警鐘を鳴らす。
進行していても、転移があっても、手術でがんの完全切除ができるなら、まずは原発巣及び転移巣の完全切除を試みることが重要だというのだ。もちろん、多臓器に多発転移がある場合は別だが、2~3個ならば、局所治療(摘出術)で十分対応できるそうだ。
理由は「分子標的療法の時代の薬物療法では、完治する確率が極めて低い」からだ。分子標的薬による全身治療は、がんを小さくすることはできても、完全になくすことは難しい。かつ、たとえ小さくなっても、分子標的薬はいずれ必ず耐性ができて、再び大きくなることがほとんど。
それに対し、局所治療で完全に切除できれば、その時点で目に見えるがんはなくなる。それと同じ効果を薬物療法で得るのは、少なくとも分子標的薬では極めて困難なのだ。
再発・転移の治療の際に「局所治療で完全に切除」「局所治療で不完全だができる限り切除」「局所治療を行わない」の3群に分けで経過を追跡したところ、「完全に切除」は10年を経て50%強が生存。全生存期間(OS)の中央値を見ると、完全切除群4.8年、不完全切除群2.6年、未切除群1.1年と、明らかな違いが出たという。つまり、全身状態(PS)が良好で手術可能であれば、原発・転移の完全切除を目指し、たとえ完全切除が難しくても、可能な限りの切除を試みる意義は十分にあると言えるだろう。
局所治療を行う一番の目的はあくまでも「完治」。だが、それだけでなく、発熱、痛み、血尿、疲労感などのつらい症状が、がんを摘出できれば大幅に取り去ることができる。とくに、「原発巣が大きくて転移巣が小さいほど、その効果が顕著です」と木村さん。摘出によって腫瘍量を減らすことが、完治はもちろん、全身症状の改善を考慮しても非常に有効なのだ。
「例えば、腎臓に原発があって、肺に転移が1個ならば、両方を完全に摘出できればその時点では完治です。もちろん時が経って再発する可能性はありますが、逆に言えば再発しないかもしれないのです。ところが、完全切除のチャンスがあるのにがんを切除しないまま薬物療法に入ってしまうと、がんは大きくならないかもしれないけれど、完治の可能性はほぼゼロ。しかもいずれ耐性ができて、再びがんは大きくなります。だから、チャンスがあるなら、まずは完全切除を目指してほしいのです」
ただし……と木村さんは付け加えた。
「手術は侵襲的であるため、手術をするためには手術に耐えられる全身状態であることが必須です。手術を選ぶのか、薬物療法を選ぶのかは、全身状態、合併症、がんの拡がり、完全切除の可能性、緩和的意義などを主治医と相談して決定してください」
腎がんの手術後、再発予防のための薬物療法の意味は?
腎がんの手術後、約3割の頻度で、その後の経過観察中に転移が出てくる。完全にがんを摘除したのに、なぜ再発するのだろうか?
「目に見えるがんを摘出した時点で、実は目に見えない微小転移がすでにあって、それが時を経て大きくなっていったということです」
それでは、がん摘出後、見に見えない微小転移巣に対しての薬物療法を行うことで、この再発は予防できるだろうか?
完全切除後の目に見えない微小転移を薬物療法によって抑えられるかという臨床試験が、腎がんでもこれまでに幾度も試みられてきた。しかし、サイトカイン療法でも、分子標的薬でも、術後補助療法(アジュバント療法)としての微小転移を叩く作用はほとんど期待できないとの結果が出た。
しかも、薬物療法には副作用がつきものだ。食欲不振、下痢、高血圧、手足の痛みなどの副作用により生活の質(QOL)が悪くなる。それなのに、肝心な再発リスクも下がらないため、腎がんにおいては、現状では術後補助療法は行われていない。転移が出て初めて治療を開始するのが一般的だそうだ。
免疫チェックポイント阻害薬オプジーボの登場
ここまでの話から「薬物療法を行うのは、転移が出て転移巣に対する局所治療(完全切除)ができないとき」ということになる。ただしこれは、腎がんの薬物療法を分子標的薬(もしくはサイトカイン療法)と考えた場合の話だ。
腎がん治療における分子標的薬の中心は血管新生阻害薬である。つまり、がんそのものを叩くわけではない。がんが栄養分を得るために作り出す新たな血管を阻害してがんを兵糧攻めにするというメカニズム(作用機序)のため、がんは大きくならずとも完治はなく、いずれ耐性ができて再び暴れ始める、というのがこれまでの腎がんにおける薬物療法だったのだ。
そこに彗星のごとく登場したのが、免疫チェックポイント阻害薬のオプジーボ(一般名ニボルマブ)。2016年、転移性腎がん・切除不能腎がんの2次治療薬として承認された。
その効果を示したのが、2015年に発表された第Ⅲ相試験であるCheckMate025試験。血管新生阻害薬での治療歴を持つ進行腎細胞がん患者を対象に、オプジーボとアフィニトールの治療比較した試験であり、腎がん治療におけるがん免疫療法の幕開けとなった試験でもある。
最近アップデートされた成績では、経過観察期間の中央値40カ月において、全生存期間(OS)の中央値はオプジーボ群25.8カ月、アフィニトール群19.7カ月、3年生存率はオプジーボ群39%、アフィニトール群30%、奏効率(ORR)はオプジーボ群26%、アフィニトール群5%と、オプジーボの効果を裏付ける結果を叩き出している。
さらに、生存率曲線は4年を超えた現時点で20%強の状態で横ばい。分子標的薬の時代は、時間の経過とともに生存率はどんどん下がっていくのが常だった。しかし、がん免疫療法薬であるオプジーボでは生存率が下がらない(治療効果の持続)、即ち「治癒」が期待できるようになったのである。これが分子標的薬の時代には見ることができなかったがん免疫療法の最大の特徴となっている。
初期治療から免疫チェックポイント阻害薬を使えるように!
現時点で、腎がんで承認されている免疫チェックポイント阻害薬は、オプジーボとヤーボイ(一般名イピリマブ)の2つ。そして、この異なったメカニズムを持つ2剤の併用療法が、未治療の進行腎細胞がんの1次治療として、昨年(2018年)8月、日本でも承認された。オプジーボ単独は2次治療からしか使えないので、初期治療で免疫チェックポイント阻害薬を使えるようになったという意味で、この承認の意義は大きい。
ただし、この併用療法を選択するにあたっては、予後予測因子を用いたリスク分類が用いられる(図2)。当てはまるリスク因子が0個の低リスクならば、スーテントやヴォトリエントなどの分子標的薬、1個以上(中等度リスク以上)ではオプジーボ+ヤーボイ併用療法となる。

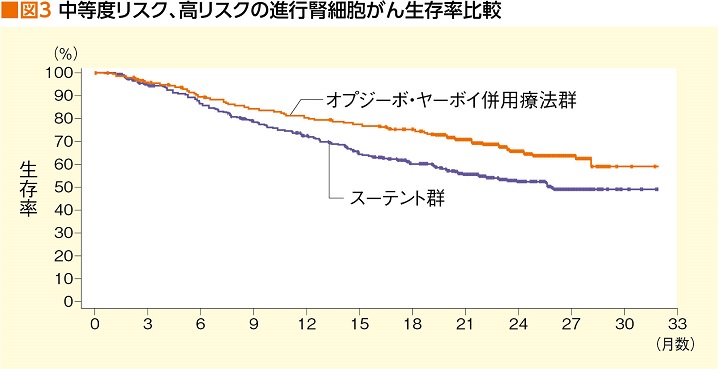
オプジーボ+ヤーボイ併用療法の効果は、第Ⅲ相試験であるCheckMate214試験で示されており、今年(2019年)2月、米国で開催されたASCO GU2019(米国臨床腫瘍学会泌尿器癌シンポジウム)では、30カ月時点での途中経過も発表された。それによると、未治療の進行腎細胞がん中等度から高リスク患者を対象に、オプジーボ+ヤーボイ併用療法群とスーテント群を比較した結果、30カ月生存率が併用療法群60%、スーテント群47%、30カ月無増悪生存率が併用療法群28%、スーテント群12%、奏効率が併用療法群42%、スーテント群29%、完全奏効(CR)率は併用療法群11%、スーテント群1%と、中等度リスク以上の患者においては、すべての項目で併用療法群がスーテント群を上回った。低リスク患者においては、以前の評価ではスーテント群が良好だったが、30カ月を経た今回の評価では有意差なしだった(図3)。
前述の2つの臨床試験を受けて、「免疫チェックポイント阻害薬が分子標的薬と決定的に違うことは、薬物療法単独で完治の可能性がある人が出てきた、ということです」と木村さんは言及する。
2次治療でオプジーボを使った人の2割強が4年を超えて生存している。そして、1次治療でオプジーボ+ヤーボイの併用療法を受けて30カ月経った現在、28%の人が無増悪生存を続けている。彼らは完治の可能性を秘めているということだ。まだ長期成績が出ていないので結論づけるのは早急だが、その可能性があるのは確かだろう。
ただし「オプジーボとヤーボイの併用は、オプジーボ単独より副作用が早期に強く出る可能性があることを踏まえておいてほしい」と木村さんは注意を促す。免疫チェックポイント阻害薬などのがん免疫療法による副作用の頻度は多くないものの、発現するときは間質性肺炎、肝障害、大腸炎、内分泌障害など多岐にわたる。そういう意味でも、がん免疫療法を受ける際は、どんな副作用が起こっても即座に対応できる、すべての診療科が揃った施設を選ぶことが肝要だ。
同じカテゴリーの最新記事
- 免疫チェックポイント阻害薬で治療中、命に関わることもある副作用の心筋炎に注意を!
- キイトルーダ登場前の時代との比較データから確認 進行性尿路上皮がんの予後が大幅に延長!
- 肺がんに対する免疫チェックポイント阻害薬の治療効果は腸内細菌が関係!
- 複合がん免疫療法が、がん薬物療法の主力に! 免疫療法の個別化医療を目指す
- 胃がん新ガイドライン「条件付き承認」で増える治療選択 1次治療でオプジーボ承認
- 乳がん治療にも免疫チェックポイント阻害薬が登場! トリプルネガティブ乳がんで承認、さらに――
- 初期治療から免疫チェックポイント阻害薬選択の時代へ 腎細胞がん治療はここまで来た!
- 患者にもわかりやすく明確化された推奨する治療・しない治療 全面改訂された「大腸癌治療ガイドライン」2019年版
- 肺がんⅢ期の化学放射線療法後にイミフィンジが効果 放射線副作用の肺臓炎をいかに抑えるかが重要
- 小細胞肺がんに17年ぶりの新薬登場! 初の免疫チェックポイント阻害薬・テセントリク承認



