薬物療法は術前か、それとも術後か 切除可能な非小細胞肺がん

切除可能でもⅡ期以降は術後補助療法が推奨される非小細胞肺がん(NSCLC)。その周術期治療に、この1年、進化が起きています。術前、術後治療に免疫チェックポイント阻害薬が登場し、EGFR遺伝子変異陽性には術後補助療法にEGFR阻害薬タグリッソが承認されました。藤田医科大学医学部呼吸器内科学講師の大矢由子さんに、手術可能な非小細胞肺がん治療の最新知見と治療選択の考え方を聞きました。
ここ1年で急激に変わった周術期肺がん治療
切除可能肺がんは再発率が高く、比較的早期から遠隔転移が起きやすいため、Ⅱ期以降は術後補助療法が行われます。頻用されるレジメンは細胞障害性抗がん薬のシスプラチン(一般名シスプラチン)+ナベルビン(一般名ビノレルビン)で、現在の『肺癌診療ガイドライン』2022年版でも標準治療として推奨されています。
ところが2022年から、周術期治療に免疫チェックポイント阻害薬(ICI)と分子標的薬が登場し、大きな変化が起きています。
2022年5月、「IMpower010試験」により、PD-L1陽性、Ⅱ~ⅢA期NSCLCに対する術後補助療法として免疫チェックポイント阻害薬であるテセントリク(抗PD-L1抗体:一般名アテゾリズマブ)が承認され、8月には、「ADAURA試験」により、EGFR遺伝子変異陽性Ⅱ~ⅢA期の術後補助療法としてEGFR阻害薬のタグリッソ(一般名オシメルチニブ)が承認されました。
続いて2023年3月、「CheckMate-816試験」を受け、EGFR/ALK遺伝子変異陰性のⅡ~ⅢA期の術前治療として、オプジーボ(抗PD-1抗体:一般名ニボルマブ)+プラチナ製剤併用療法が承認されました。
「現在、肺がん周術期治療は過渡期の真っ只中で、昨年はガイドラインの扱いでも大きな議論が起こりました。一番俎上に上がったのは、タグリッソの『推奨度決定不能』でした。これは、ガイドラインの推奨度決定の投票時期が承認前だったことや、術後治療の真のエンドポイントとされる全生存期間(OS)のデータがその時点でまだ十分ではなかったことなどによります。
ただ、先日(2023年6月)の米国臨床腫瘍学会(ASCO 2023)でタグリッソがOSで有意な延長を示したと発表されましたので、今後、ガイドラインの推奨度も再考されると思います」と藤田医科大学医学部呼吸器内科学講師の大矢由子(おおやゆうこ)さんは語ります。
術後補助療法にテセントリク承認
周術期治療について、免疫チェックポイント阻害薬から見ていきましょう。
切除可能な肺がんの中でもⅡ期以上(ⅡA~ⅢA期)が術前・術後治療の対象です。
「これまでの細胞障害性抗がん薬による術後補助療法は、5年生存率を5%程度上乗せします。4サイクルで3カ月間かかり、患者さんの負担はそれなりに大きいのに上乗せ効果は5%と少し物足りないものでした。そんな中、免疫チェックポイント阻害薬テセントリクが登場したのです(IMpower010レジメン)」と大矢さん。
IMpower010レジメンでは、術後1~4回のプラチナ併用療法を行った後、テセントリクを1年間投与します。支持療法(BSC)群に対して、化学併用療法後のテセントリク群が無病生存期間(DFS)を有意に延長し、昨年承認されました。「ただ、テセントリクによる免疫関連有害事象の取り扱い、さらに臨床試験でも治療関連死亡が出ていることは重く捉えないといけない」と大矢さんは指摘します。
術前治療にオプジーボ登場!
さらに今年3月、「CheckMate-816試験」の結果を受けて、EGFR/ALK陰性Ⅱ~ⅢA期に対して、術前にオプジーボ+プラチナ製剤併用療法が承認されました。CheckMate-816レジメンは、オプジーボ+化学併用療法を3週おきに3サイクル(9週間の術前治療)、その後、画像評価を行った上で手術を行います。
CheckMate-816試験においては、オプジーボ+化学療法群(以下オプジーボ群)と化学療法群が比較され、主要評価項目は、無イベント生存期間(EFS)と病理学的完全奏功(pCR)率でした。
「EFSは、化学療法群20.8カ月に対してオプジーボ群は31.6カ月、ハザード比0.63と有意に延長しました。OSはまだ両群ともに未到達ですが、オプジーボ群で良好な傾向です」(図1)
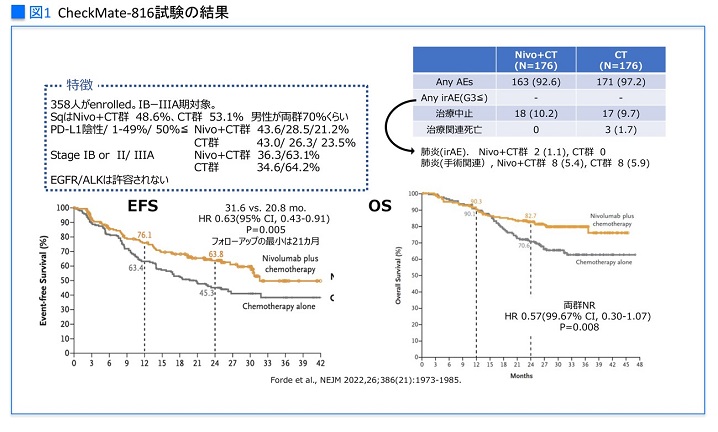
さらに最近、欧州肺癌学会(ELCC2023)にて3年フォローアップ結果が発表され、EFSもOSもオプジーボ群が生存曲線で化学療法群を上回り、差は縮まらないことが示されています。
ただ、術前治療の場合、「有害事象によって、〝手術できなくなるかもしれない〟ことが何より大きな問題点です」と大矢さんは指摘します。
CheckMate-816試験で、手術不能になる率がⅡ期ではオプジーボ群12%、化学療法群13%と同等なのに対し、Ⅲ期ではオプジーボ群17%、化学療法群25%と差が開き、化学療法群で多く認められた手術不能理由は疾患進行でした。
「疾患進行はそもそも手術をしても早々に再発したと考えられますので、このような患者さんはやむを得ませんが、それでもそこを理解してもらえる説明を治療前にしなければなりません。また、有害事象で手術ができなくなることは患者さんにとって大きな損失です。術前治療を受ける患者さんは手術を前提に治療を受けにきている人たちなので、手術不能になるリスクが悩ましく、治療前に十分な説明と同意が必要です」と大矢さんは話します。
術前治療のメリットとデメリットは?
手術可能な肺がんⅡ~Ⅲ期に免疫治療を受ける場合、術前と術後治療、どちらを選択したらよいのでしょうか。まずは免疫チェックポイント治療のしくみを確認しましょう。
免疫細胞はがんを認識すると、まずリンパ球に「これががん細胞だよ」と覚え込ませます(抗原提示)。こうしてがんを認識したリンパ球が、がん細胞と闘うのですが、がん患者さんではそこにブレーキがかかって攻撃できない状態になっています。そのブレーキを解除してリンパ球ががんに対して攻撃できるようにするのが免疫チェックポイント阻害薬の治療。つまり、闘っているのは自らのリンパ球なのです。
「ところが術後治療だと、手術でがんが切除されているので抗原となるがんがなく、さらにリンパ節郭清によって、がん細胞を認識した戦い手(兵士)のリンパ球も取り除かれている可能性があります。そのため、免疫治療においては術前のほうが効率的かもしれません」と大矢さん。
ちなみに、術前術後どちらの治療がよいかは、「S1801試験」という比較試験が悪性黒色腫(メラノーマ)ですでに行われています。キイトルーダ(一般名ペムブロリズマブ)を術前3回→手術→術後15回(術前術後群)と手術→術後18回(術後群)を比較したところ、キイトルーダの投与回数は同じですが、DFSは術前術後群が良好。術前治療のメリットが示されました。
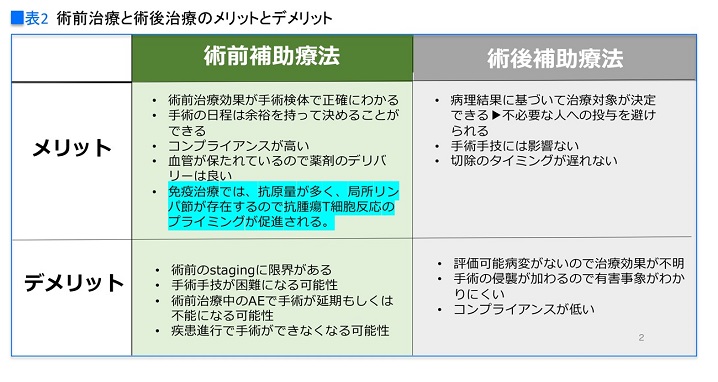
「他にも術前治療のメリットとしては、血管が保たれているので抗がん薬ががんに届きやすく、また、術前治療の効果は画像で評価できるので、患者さんの治療モチベーションにも繋がりやすいかもしれません」
一方、術前治療のデメリットは、術前の病期(ステージ)診断の難しさです。
「画像診断や気管支鏡でリンパ節のどこまでがんが進展しているかを調べますが、肺がんはこれが非常に難しいのです。Ⅱ期だと思ったらⅢ期だったり、逆もしかり。画像所見でも、例えば喫煙者はリンパ節全体が腫れていることもあって判断が難しく、半分ほどは術前と術後のステージングが変わるという報告もあります。それほどに術前の病期診断には限界があるのです」
そして、いちばんのデメリットは前述のとおり、有害事象や病勢進行によって手術ができなくなる可能性があることでしょう(表2)。
術後治療のメリット、デメリット
一方、術後補助療法のメリットは、手術検体による病理検査で治療対象を決定するので、必要のない患者さんへの抗がん薬治療を避けられること。また、「患者さんにとっては、確実に手術できることも術後治療のメリットかもしれません」と大矢さん。
とはいえ、術後治療ならすべての治療ができるかというとそれも違うようです。
「IMpower010試験では1,280人が登録しましたが、手術、化学療法後に試験治療(テセントリクもしくはBSC)へ進めたのは1,005人です。つまり20%以上では病勢進行も含むさまざまな理由で、免疫治療を行うことができませんでした」
また、「すでに手術で腫瘍を切除しているので、抗がん薬治療を受けている患者さんからは、『何と闘っているかわからない』と言われることもあります」と大矢さん。これも術後補助療法のデメリットと言えるでしょう。
同じカテゴリーの最新記事
- 新薬や免疫チェックポイント阻害薬も1次治療から 胃がんと診断されたらまずMSI検査を!
- リムパーザとザイティガの併用療法が承認 BRCA遺伝子変異陽性の転移性去勢抵抗性前立腺がん
- 免疫チェックポイント阻害薬で治療中、命に関わることもある副作用の心筋炎に注意を!
- SONIA試験の結果でもCDK4/6阻害薬はやはり1次治療から ホルモン陽性HER2陰性の進行・再発乳がん
- dose-denseTC療法も再脚光を ICI併用療法やADC新薬に期待の卵巣がん
- 心不全などの心血管の副作用に気をつけよう! 乳がんによく使われる抗がん薬
- 新規薬剤の登場でこれまでのサブタイプ別治療が劇的変化! 乳がん薬物療法の最新基礎知識
- 世界最大規模の画期的研究の一部解析結果が発表 大腸がんの術後補助療法の必要性をctDNAで判断する
- 「過剰検査・過剰治療の抑制」と「薬物療法の進歩」 甲状腺がん治療で知っておきたい2つのこと



