「ホルモン受容体陽性・HER2陰性」で抗がん薬の追加治療を迷うときに
乳がんの増殖能を判定する Ki-67値をどう扱うか

「ホルモン受容体陽性・HER2陰性」タイプの乳がんで、がん細胞の増殖能が高いと判断される場合には、術後補助化学療法としてホルモン療法に加え、抗がん薬治療が行われる。この増殖能が高いか低いかの判断材料に用いられるのが、Ki-67という核内のタンパク質だ。しかし、測定法が標準化されておらず、施設ごとに判断基準も異なるため、注意が必要だ。
ホルモン受容体陽性、かつHER2陰性タイプの問題
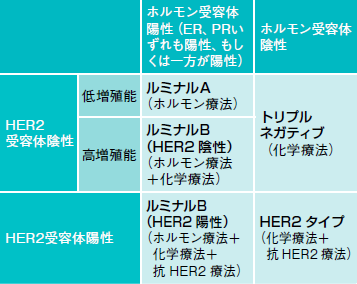
乳がんはがん細胞の性質によって5つのサブタイプに分類される(図1)。
サブタイプには、まず、「ホルモン受容体」と「HER2受容体」がそれぞれ陽性か陰性かによる4つの組み合わせがあり、その中の「ホルモン受容体陽性・HER2陰性」をがん細胞の増殖能の程度によって【低増殖能タイプ】と【高増殖能タイプ】に分けている。
これらのサブタイプ別に推奨される薬物療法があり、ホルモン受容体陽性タイプではホルモン療法が効果的だが、がん細胞の増殖能が高い場合は再発の可能性も高いので、それに加えて抗がん薬治療を行う。
抗がん薬治療はいうまでもなく患者さんにとって大きな負担になるため、本当に必要な人を見極めて実施したいところだ。しかし、がん細胞の増殖能を正確にとらえるのは難しく、抗がん薬治療を追加するかどうかの選択に悩むケースが多々ある。
増殖能を示す Ki-67とはどのようなマーカーか
Ki-67は細胞の増殖能を表すマーカーである。京都大学大学院医学研究科標的治療腫瘍学講座の新倉直樹さんは次のように説明する。
「乳がん細胞を免疫組織染色してKi-67という核内タンパク質が染まる細胞は増殖期にあるもので、それが多ければ腫瘍の活動性として増殖能が高いことを示します。Ki-67が高値であるということは悪性度が高く再発しやすい。つまり予後が悪いと言えます」
新倉さんの前任地である東海大学医学部乳腺・内分泌外科では2002年から患者さんのKi-67を測定しており、1,300例以上のデータが蓄積されていた。
これを分析したところ、Ki-67は乳がんのサブタイプのうちホルモン受容体陽性・HER2陰性のグループで予後マーカーとなることが明らかになった(図2)。
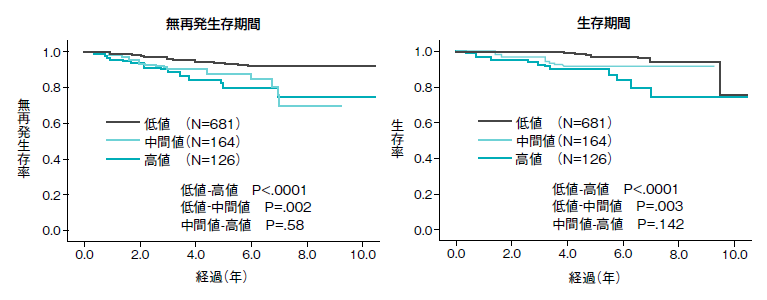
Ki-67はホルモン受容体陽性・HER2陰性の患者さんの術後補助療法を決定する指標として研究が始められ、Ki-67が高値ならば再発予防のために抗がん薬治療を追加するのが、今の時点での標準治療となっている。ここで理解しておくべきことは、Ki-67の値だけで抗がん薬治療をするかどうかは判断できないということだ。
「Ki-67の測定値は施設によって、また病理医間で相当なばらつきのあることが知られています。Ki-67の重大な問題点はこの再現性のなさです。どこからが高値でどこからが低値なのかということが定まっておらず、抗がん薬治療をするかしないかの基準値もわかっていません」
このように新倉さんは話す。
「病理医間で判定がまちまち」 Ki-67の決定的な問題
再現性がないとは、どういうことか。「同じ腫瘍から作製した標本を何人かの病理医が読んだとき、例えばKi-67の発現率10%と全員がカウントするわけではないのです。染色の仕方など計測の方法などを含めてぴたりと揃うことがありません。5人の病理医が読むと、同じ標本を8%と判定する人、20%と判定する人、18%と判定する人などとまちまちなのです」
この問題について、日本乳癌学会では病理医間でのKi-67の一致率を検討する研究班が設置され、新倉さんもこれに参加した。その結果が今年(2014年)7月に大阪で開かれた第22回同学会学術総会で発表されている。
研究では、2007年に東海大学で手術したホルモン受容体陽性、HER2陰性の乳がん患者さん110人分の標本について、乳腺専門の実績ある病理医6人がそれぞれのやり方でKi-67を測定。病理医AによるKi-67の測定値と病理医B、C、D、E、Fの測定値が一致するかどうかを、13.25という*カットオフ値を置いて検証した。その結果、一致率が悪いというものであった(図3)。
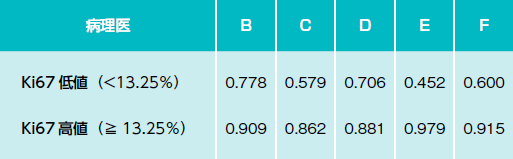
「つまり、13.25%を基準にしてそれ以下なら低値なので抗がん薬は不要だとするならば、患者さんにどういうことが起こるかというと、病理医Aに判定されると抗がん薬治療をしたほうがいいと言われ、Eに判定されるとしなくてもいいと言われるようなことが起こるわけです。本来ならば、最低90%以上の一致率が欲しいところです」
かつては14%や20%というカットオフ値が提唱されたこともあるが、現在では参考程度という扱いで、臨床的なカットオフ値は置かないようになっている。
「Ki-67を単独の指標として、何%という値で区切って、抗がん薬治療をする・しないの指標に用いるようなことはすべきでないのです」このように、新倉さんは強調する。
研究班はKi-67の標準化を検討し、標本作製と計測方法の提言をまとめたという段階だ。臨床的なエビデンス(科学的根拠)の確立はまだまだ先と新倉さんは考えている。
*カットオフ値=病態識別値ともいう。検査結果の陽性と陰性を鑑別する数値。この場合、Ki-67の高値群と低値群を分ける数値
迷うときはオンコタイプDXも選択肢に

治療方針を決めるときにどうしても迷うならば、新倉さんは遺伝子検査のオンコタイプDXを勧めるという。
「オンコタイプDXは米国で開発され、広く行われている遺伝子検査です。日本から米国の会社に送った患者さんの組織検体を、そこの施設だけで測定しています。そのため、病理医によって結果が異なるという、Ki-67検査で起こるような問題は生じません」
オンコタイプDXは生検や手術で取り出した乳がん組織を用いて再発にかかわる21種類の遺伝子を調べ、どの程度再発しやすいか、また、術後化学療法がどの程度効くのかを予測するものだ。21種類の中にはER(エストロゲン受容体)やHER2、Ki-67も含まれている(図4)。
それらの遺伝子の発現状況によって再発スコアが算出され、「低リスク(スコア0~17点)」「中間リスク(同18~30点)」「高リスク(同31~100点)」に分類される。再発スコアが高リスクなら抗がん薬治療を追加、低リスクならホルモン療法のみ実施というように、治療方針の判断材料とするわけだ。
「オンコタイプDXの日本人のデータを見れば高リスクに入る人が4~5割、低リスクに入る人が2~3割、中間リスクが3~4割くらいです。Ki-67でもグレードでも迷う人はやはりやりオンコタイプDXでも中間リスクという結果が出るものです。そういった中間リスクの人たちに抗がん薬治療を実施したほうがいいのかどうか、臨床試験が現在進行中です。その結果が出て抗がん薬治療をするかしないかの線引きが明確になれば、オンコタイプDXで調べるのがベストということになるでしょう」
日本でオンコタイプDXを希望する患者さんはまだ少数だ。保険適用になっておらず自費で35万円程度かかる高額な検査ということもあって普及には至っていない。金銭的な面からオンコタイプDXの代用として、新倉さんは患者さんに「オンコタイプDXがいいのだが、Ki-67でも似た予測は可能だ」と説明しているという。
HER2が陰性に変化することも!? 再発時の遺伝子検査にも注目
乳がん治療では遺伝子を調べて合理的な治療を選択するようになってきているが、Ki-67については研究を重ねてきた新倉さんだからこそ、「Ki-67を指標に用いることが個別化医療の推進につながるが、まだまだエビデンスが足りない」と断言する。とはいえ、乳がんにおける個別化医療の進展は留まることがないのも事実だ。
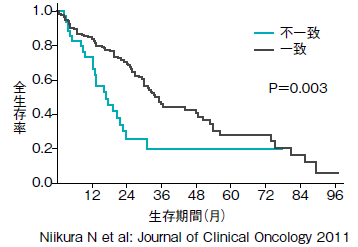
例えば新倉さんはHER2陽性タイプの乳がんが再発した場合、再発巣ではHER2が陰性になっている症例があることに着目。HER2が陰転化した人たちは再発が起こってからの予後が不良であることを明らかにした(図5)。再発時に適切な治療が行えるよう、再発した乳がん細胞を調べることが必要な場合もあると提言する(図6)。
このような中、患者さんは「自分のがんについて、治療を迷うときは主治医とよく相談することが今後ますます大切になります」と新倉さんは話す。
(再発前後でHER2遺伝子診断が不一致だった人、一致した人)