あなたの骨髄、血液細胞は大丈夫ですか? 要注意は高齢、抗がん剤、放射線被曝
染色体異常による予後予測も可能に
骨髄異形成症候群はいくつかのタイプに分類されている。
1980年代には、FAB分類によって、5つの病型に分類されていた。この分類法の基軸は芽球の比率。つまり、白血病への移行しやすさに主眼が置かれた。
FAB分類に代わり、2001年にはWHO(世界保健機関)が、骨髄異形成症候群の新しい知見に基づいた病型分類を発表した。WHO分類は2008年に改訂され現在、7つの病型に分類されている。
「芽球の比率は白血病への移行に最も大きく関わっていますが、それだけで分類してしまうと、同じ病型でも予後が違うことがありました。その後、血液細胞の異形成も予後に大きく関係していることがわかり、それを加味したWHO分類が生まれたわけです」
90年代後半からは染色体の検査も普及したため、WHO分類では、単独の5番染色体長腕部の異常を伴う病型を、5qマイナス症候群として独立させた。
08年の改訂では、「単一系統の異形成を伴う不応性血球減少症(RCUD)」という病型も新設された。不応性貧血では赤血球減少にしか対応しないが、RCUDなら白血球減少にも血小板減少にも対応できるからだという。
| 病型 | 末梢血所見 | 骨髄所見 |
|---|---|---|
| 単一系統の異形成を伴う 不応性血球減少症(RCUD) | 血球減少≦2※汎血球減少はMDS-U 芽球(-)/まれ(<1%)※1%はMDS-U | 単血球系に異形成(十)>10%、 芽球<5%、環状鉄芽球<15% |
| 鉄芽球性不応性貧血(RARS) | 貧血、芽球(-) | 赤芽球系のみ異形成(十)、芽球<5%、 環状鉄芽球≧15% |
| 多系統の異形成を 伴う不応性血球減少(RCMD) | 血球減少≧2、芽球(-)/まれ (<1%)※1%はMDS-U アウエル小体(-) 単球<1×103/μL | 2系統以上(好中球および/または赤芽球および /または巨核球)に異形成(十)≧10%、 芽球<5%、環状鉄芽球±15%、 ア���エル小体(-) |
| 芽球増加を伴う不応性貧血-1 (RAEB-1) | 血球減少、芽球<5% アウエル小体(-) 単球<1×103/μL | 単血球系/多血球系に異形成(+)、 芽球5~9%、アウエル小体(-) |
| 芽球増加を伴う不応性貧血-2 (RAEB-2) | 血球減少、芽球5~19% アウエル小体(±) 単球<1×103/μL | 単血球系/多血球系に異形成(十)、 芽球10~19%、アウエル小体(±) |
| 分類不能型MDS(MDS-U) | 血球減少、芽球<1% | MDSに特異的な染色体異常を伴い単血球系 /多血球系に明らかな異形成(+)<10% 芽球<5% |
| 5q-症候群 | 貧血、芽球(-)/まれ(<1%) 血小板数:正常/増加 | 低分葉核を有する巨核球:正常/増加、 芽球<5%、アウエル小体(一)、 del(5q)の単独異常 |
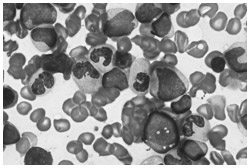
骨髄異形成症候群の病型の1つであるRAEB-1の骨髄
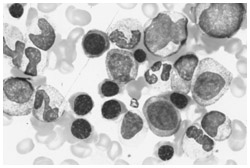
正常な骨髄
骨髄異形成症候群と診断され、病型分類を行ったら、治療方針を決定することになる。そこで、必要となるのが予後予測。とくに骨髄異形成症候群にはさまざまなタイプがあるので、予後をよく見極め、それに応じた治療法を選択することが肝心だ。
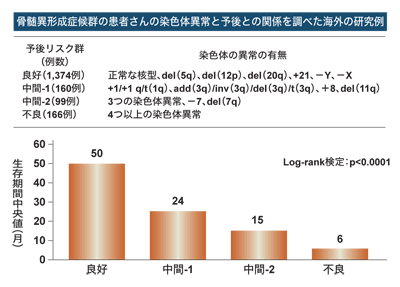
1997年には、骨髄異形成症候群の予後予測法としてIPSS(国際予後因子分析システム)が発表された。これは、芽球の比率、異常の現れた血液細胞の種類や血球数、染色体異常の有無によって点数をつけ、その点数によって低リスク、中間リスク1、中間リスク2、高リスクの4段階に分けるもの。
「この予後予測法は非常に使いやすかったので、その後の骨髄異形成症候群の臨床試験などでは、この評価に基づいて試験が行われてきました」
さらに、遺伝子技術を活用した予後予測法の研究も進んでいると宮崎さんは言う。
「現在、世界中の研究者が共同して、約8000の症例をもとに染色体異常と予後との関係について詳細に解析しています。この研究には私も参加しています。今年中には結果がまとまり、報告される予定です。新しい予後予測法が確立されれば、骨髄異形成症候群の治療選択がより適切に行われると期待できます」
化学療法の可能性が広がっている
骨髄異形成症候群の治療の基本は対処療法だ。病状が落ち着いていれば、対処療法だけで様子を見ていくことも可能だ。病状が進行していく場合には、化学療法や造血幹細胞移植が選ばれる。ただし、どちらも強い副作用があるので、ベネフィット(利益)とリスクの兼ね合いをよく見極める必要がある。造血幹細胞移植は、骨髄異形成症候群の完治を目指せる唯一の治療法だが、リスクが高く、基本的には高齢者は対象とならない。
しかし、最近では、骨髄異形成症候群の治療法も大きく変わってきた。というのも、骨髄異形成症候群の新薬が続々と開発され、化学療法の可能性が広がっているからだ。現在、臨床試験中や承認申請中の薬がいくつもある。
「ビダーザ(一般名アザシチジン)は未承認ですが、欧米で余命を延ばすと証明された初めての薬。レブラミド(一般名レナリドミド)にも期待しています。この薬は、骨髄異形成症候群の異常な細胞の増殖を抑え込むという働きもします。現在のところ、理由は不明ですが、5番染色体長腕部の一部が欠けている人によく効くと言われています。もし、そのメカニズムがわかれば、ほかのタイプの骨髄異形成症候群の薬剤開発にも応用できるかもしれません」
これまで治療が困難だった骨髄異形成症候群だが、医学の進歩に伴って予後を確実に改善できるようになったと、宮崎さんは力強く語った。
(構成/柄川昭彦)
同じカテゴリーの最新記事
- 日本での新薬承認が待たれる 骨髄異形成症候群の最新薬物療法
- 骨髄異形成症候群(MDS)の正体を知ろう 高リスクの骨髄異形成症候群にはビダーザが決定打。今後の新薬承認に期待
- 造血幹細胞移植患者のリハビリは「継続する」ことが大切
- リスクに応じた治療戦略がカギ 骨髄異形成症候群の最新治療
- レブラミドやビダーザなどの新薬で治療成績は向上 新薬で白血病への移行をストップ!骨髄異形成症候群の最新治療
- 治療法がなかなかなかった難治性の病気に、延命への希望が生まれた 2種類の薬の登場により骨髄異形成症候群の治療は新時代へ!
- 大型新薬の登場で、薬物療法の選択肢が広がっている 完治も期待できるレブラミド。高リスクに有効な新薬も承認間近
- 早期に見つけるには年1回以上の血液検査を 「貧血」「出血傾向」「抗がん剤経験者」に要注意!


