サリドマイドの誘導体レナリドミドの高奏効が明らかに。新薬も検討中 病態解明に確実な進歩。骨髄異形成症候群の最新治療
中間リスク2からは移植も
IPPSは、骨髄異形成症候群の予後を点数で評価して4つのランクに分類する予後予測法だ。
具体的には、(1)骨髄の芽球の割合、(2)末梢血中で3種類のうち何種類の血球が減少しているか、(3)染色体異常の種類と程度によって、低リスク、中間リスク1、中間リスク2、高リスクと4段階にリスクを分けている。
| 予後因子 | 配点 | ||||
|---|---|---|---|---|---|
| 0 | 0.5 | 1.0 | 1.5 | 2.0 | |
| 骨髄中の芽球の比率 | <5% | 5~10% | - | 11~20% | 21~30% |
| 染色体異常* | 良好 | 中間 | 不良 | ||
| 血球減少** | 0あるいは1 | 2あるいは3 | |||
不良:3種類以上の染色体異常、7番染色体の異常
中間:その他の染色体異常
**白血球、赤血球、血小板の中で減少している種類の数
| スコアリングの合計点 | |
|---|---|
| 低リスク群 | 0 |
| 中間-1リスク群 | 0.5~1.0 |
| 中間-2リスク群 | 1.5~2.0 |
| 高リスク群 | ≧2.5 |
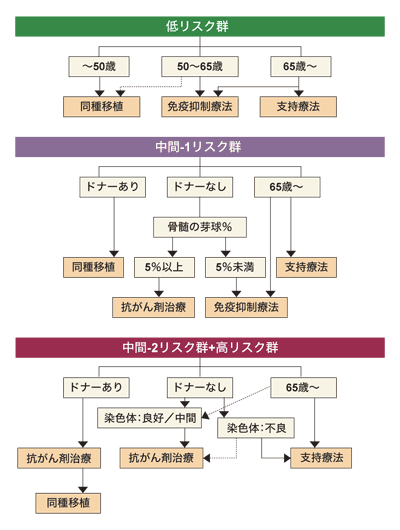
たとえば、芽球の比率は20パーセント以上が1番悪く、血球の減少は0から1種類よりも2から3種類のほうが評価が悪い。染色体異常は「7番染色体の長腕や3番染色体の長腕に異常があると、予後が非常に悪いことがわかっています。染色体異常がたくさんあると、これも予後が悪くなります。逆に染色体異常がなかったり、5番染色体の長腕欠失の場合は、同じ染色体異常でも予後がいいのです」と、小川さんは説明している。これに、60歳以上という年齢が加わると、年齢だけで白血病に移行する率が高まり、リスクが高くなるのだそうだ。
「たとえば、60歳以下で低リスクの人の場合、10年経過しても60パーセントぐらいの人が生存しています。骨髄移植をすれば完治する可能性もありますが、場合によっ��は合併症で半年で命を失うかもしれません。こういう場合はまず経過をみて、悪くなったらまた考えるのが普通です。低リスクなのに、いきなり骨髄移植を考えることはありません」
骨髄移植を行うかどうか、考える境目になるのは、中間リスクの1。中間リスクの2になると「ベストなドナーが見つかった場合に、病気の進行を考慮した上で移植を行うことを考えるのが一般的」だそうだ。高リスク群になれば、可能な限りは移植を考えることになる。ただ、「こうした基準に該当して60歳以下、かつドナーが見つかる人となると、現実には決して多くはないのが実情」だという。
では、造血幹細胞移植の成功率はどのくらいなのだろうか。小川さんによると、貧血がメインで芽球の増加がないRAの場合、世界的な統計では成功率は50パーセントほど。芽球が増加していると、移植しても成功するのは3割程度だそうだ。この中には、低リスクから高リスクまでいろいろな人が含まれているが、移植にはかなりのリスクを伴うことがわかる。
ただ、日本はもっと成績がよく「RAならば7~8割、芽球が増えている場合でも4割ほどは成功します」と小川さん。もっともこの数字には、移植経験が豊富で思慮深い治療を行う施設、という前提条件がある。
「結論からいうと、血縁者にドナーがいて、リスクが中間の2以上、輸血を続けていないと生命を維持できないようなケースでは、移植に積極的な医師が多いと思います。年齢は、施設にもよりますが、基本的に60歳以下が適応。あとは患者さんの考え方によります」と小川さんは指摘する。
少しでも完治の可能性があるのならば移植にかけたい、という人もいれば、もう十分生きてきたから穏やかに残された日々を暮らしたい、と考える人もいる。それは、患者さんの人生観しだいなのである。
若くても移植の条件にあてはまらなければ、強力な化学療法を行うのも選択肢の1つ。60歳を超えて、全身状態も悪く、これまでにも治療経験があるようなケースには、輸血や感染症のコントロールなどの支持療法を中心として治療を行い、化学療法が必要な場合でも、低用量の化学療法を行うことが多い。さらに高齢で白血病に近い状態であれば、支持療法でできるだけ苦しまないことが優先して考えられるそうだ。
サリドマイドで輸血不要に
残念ながら、ここ20年、骨髄異形成症候群には、慢性骨髄性白血病に対するグリベックのような特効薬は登場していない。その中で、唯一大きな進歩をとげたのが、染色体5番の長腕に欠失のある5q-症候群というタイプだ。小川さんによると、「このタイプには、サリドマイドの誘導体であるレナリドミドが90パーセント以上に奏効することがわかり、すでに欧米では治療に使われている」とのこと。
5q-症候群はもともと予後が良いタイプだが、レナリドミドを使うと、貧血で輸血が必要だった人が輸血が不要になったり、輸血回数が減るという。残念ながら、日本にはあまり多いタイプではないが、ようやく日本でも治験が終了し、認可を待っている段階だ。小川さんによると「5q-症候群ではなくとも、同じ染色体異常があれば、効く可能性が大きい」そうだ。
一方で、欧米では以前から使われている5アザシチジン(*一般名も同じ)やダゴジエン(*一般名デシタビン)などの脱メチル化剤が、日本ではいまだに認可されていない。
「これらの薬は生存期間中央値が半年ほど伸びるだけですが、効く人の場合、輸血が必要なくなることもあります。効果は限られていますが、選択可能な治療法の少ない現状にあって、有効性が客観的に示されている薬剤として、日本でも現在治験が進行中です」と小川さんは現状を話す。
補充療法でも、似たような事態が起きている。不応性貧血で輸血を繰り返していると、体内に鉄がたまってくるのだそうだ。それを放置すればますます造血機能が低下するが、これを取り除く除鉄剤も、日本でも認可され、ようやく使えるようになったのだという。
欧米では、RAS阻害剤など発病に関わる遺伝子の転写阻害剤も開発されている。副作用も大きいので治療法としての評価はまだ不明だが、全く使えないので吟味もできないのが日本の現実だ。
小川さんによると、遺伝子の面からの病態解明は、大分進んできたそうだ。RUNX-1など造血をきちんと行うためのマスター遺伝子が異常をきたしていることもはっきりしてきた。ネズミの研究では、この遺伝子が異常を起こすと、造血が起こらなかったり、できた血球に異常があることも示されている。
染色体レベルでは、染色体5番の長腕と7番の長腕の異常が同時にあると、予後が悪くなるとのこと。さらに12番の短腕の異常も一緒にあると、さらに予後が悪いことがわかっている。8番の異常ならば予後がいいなど、染色体異常から、病気を細分化することも可能になってきたそうだ。そこから、細胞内に信号を伝達するチロシンキナーゼの異常が起こることもわかってきた。
*5アザシチジン=2006年、米国で骨髄異形成症候群の治療薬として承認済
*ダゴジエン=2004年、米国で骨髄異形成症候群の注射用懸濁剤として承認。日本でも「未承認薬使用問題検討会」で検討された
まずはドラッグラグ解消を
「ここ20年ほどの間に抗生剤や抗真菌剤などの進歩で患者さんのQOL(生活の質)はずいぶん向上し、若い人の一部は移植医療の進歩で救えるようになりました。しかし、まだ高齢者の骨髄異形成症候群は厳しいのが実情です。一方で遺伝子レベルでは造血をきちんと進めるマスター遺伝子の異常など、かなり病態解明が進んでいます。こうした研究から、新たな治療薬が開発されることも夢ではありません。そこに期待してほしい」と小川さん。ただ、そこに日本の寄与は非常に少ない、と残念そうに語った。
まずは、欧米では一般的に使っている薬がいまだに日本では使えないドラッグラグという日本の現実を一刻も早く解消してほしいものだ。
同じカテゴリーの最新記事
- 日本での新薬承認が待たれる 骨髄異形成症候群の最新薬物療法
- 骨髄異形成症候群(MDS)の正体を知ろう 高リスクの骨髄異形成症候群にはビダーザが決定打。今後の新薬承認に期待
- 造血幹細胞移植患者のリハビリは「継続する」ことが大切
- リスクに応じた治療戦略がカギ 骨髄異形成症候群の最新治療
- レブラミドやビダーザなどの新薬で治療成績は向上 新薬で白血病への移行をストップ!骨髄異形成症候群の最新治療
- 治療法がなかなかなかった難治性の病気に、延命への希望が生まれた 2種類の薬の登場により骨髄異形成症候群の治療は新時代へ!
- 大型新薬の登場で、薬物療法の選択肢が広がっている 完治も期待できるレブラミド。高リスクに有効な新薬も承認間近
- 早期に見つけるには年1回以上の血液検査を 「貧血」「出血傾向」「抗がん剤経験者」に要注意!
- あなたの骨髄、血液細胞は大丈夫ですか? 要注意は高齢、抗がん剤、放射線被曝


