渡辺亨チームが医療サポートする:腎臓がん編
渡辺亨チームが医療サポートする:腎臓がん編
篠原信雄さんのお話
*1 分子標的薬
これまでのがん治療に用いられる抗がん剤は、がん細胞を攻撃するとき、正常な細胞にもダメージを与えました。分子標的薬はがん細胞特有の仕組みに着目して、その仕組みを抑えてがん細胞にダメージを与える目的で開発された薬です。
分子標的薬には大きく分けて、がん細胞自体の増殖に関わる仕組みを抑える薬と、がん細胞自体でなくがんに栄養を与える血管ができるのを抑える薬があります。よく知られている薬ですが、消化管間質細胞腫瘍(GIST)の治療薬であるグリベックは前者に属しますし、本文中にでてきたネクサバールやスーテントは後者に属します。
腎臓がんは通常血管が豊富で、その発生、増殖の仕組みに血管新生が大きく関わっているため、血管ができることを抑える目的で開発された分子標的薬に大きな期待が集まっています。
*2 ネクサバール
がん細胞そのものの成長や、がん細胞に栄養分を届ける血管の形成に関係する成長因子(血管内皮成長因子VEGF)を抑える作用を持った経口の分子標的薬です。2005年12月にFDA(米国食品医薬品局)で承認されて以来、世界各国で発売されたり発売準備中です。
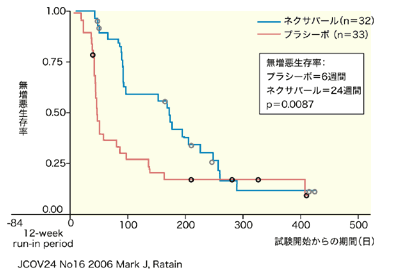
2005年のアメリカ臨床腫瘍学会(ASCO2005)では、フランスの医師から無作為化二重盲検プラシーボ(偽薬)対照多施設臨床試験(第3相臨床試験)の結果が報告されました。進行性腎細胞がんで、本文の患者さんと同様にインターフェロンなど、免疫療法薬を投与したにも関わらず効かなくなった903名の患者さんが参加した臨床試験で、ネクサバールが無増悪生存期間(がんが増えたり悪化しない期間)を延長するという成績が発表されました。
この試験では、進行もしくは死亡までの期間がプラシーボ群では84日であったのに対し、ネクサバール投与群では167日と、2倍に延長することが示されています。
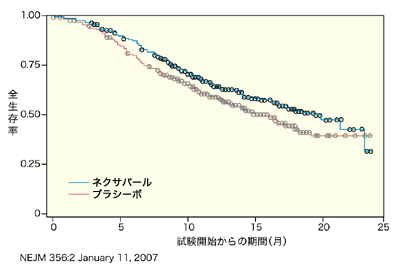
また、ASCO2006では、全生存期間についての中間発表が行われ、ネクサバールの延命効果が報告されました。このデータによると、ネクサバール治療を受けていた患者さんの全生存期間は、中央値で19.3カ月であったのに対し、プラシーボ投与群では 15.9カ月でした。ネクサバールの治療を受けたほうが、より生存期間が長くなる傾向にあることがデータによって示されています。
なお、ネクサバールは肝がん、転移性悪性黒色腫、非小細胞肺がんなどについて臨床試験が進められてきましたが、現在では日本での臨床試験は終了しています。
[ネクサバールの標的病変の最大縮小��]
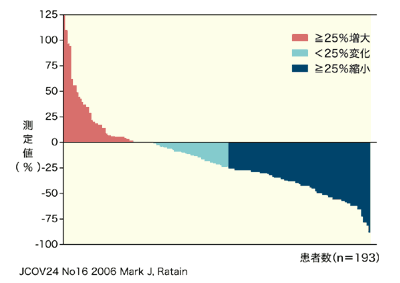
[ネクサバールの海外第3相試験の奏効率]
| 奏効率 | ネクサバール (n=451) | プラシーボ (n=452) |
|---|---|---|
| 完全寛解 | 1(<1%) | 0(0%) |
| 寛 解 | 43(10%) | 8(2%) |
| 不 変 | 239(53%) | 333(74%) |
| 進 行 | 167(37%) | 56(12%) |
| 不 明 | 38(8%) | 18(4%) |
[ネクサバールの海外第3相試験]
*3 スーテント
ネクサバールと同様に、がん細胞に栄養分を届ける血管の形成に関係する成長因子(血管内皮成長因子VEGF)を抑える作用を持った経口の分子標的薬です。FDAは、2006年2月に進行性腎細胞がんの治療薬としてスーテントを認可しました。2つの大きな臨床試験の結果を踏まえたものです。
1つ目の臨床試験は106人の患者、2つ目の試験は63人の患者を対象にしたものです。これらの臨床試験に参加した患者さんは、ネクサバールと同様に、インターフェロン投与など免疫療法に抵抗性となった遠隔転移を有する方でした。その結果、1つ目の試験では34パーセント、2つめの試験で36.5パーセントの患者さんで腫瘍が明らかに縮小しました。この縮小効果は平均8カ月持続しました。この結果は、ネクサバールよりもすぐれたものです。
しかし、副作用はネクサバールより強いようです。スーテントの副作用としては、骨髄抑制、高血圧、脱力感・倦怠感、手足の有痛性水泡性病変(Hand-foot syndrome)などが多いようです。それ以外に心電図異常、甲状腺機能障害が最近報告されており、今後十分な注意が必要と思われます。
一方、ASCO2006に、遠隔転移を有する腎がん患者さんに初期治療として、スーテントまたはインターフェロンを投与し、効果を比較する大規模多施設臨床試験(第3相臨床試験)の結果が報告されました。その結果、スーテントでは31パーセント、インターフェロンでは6パーセントの患者さんで腫瘍の縮小が得られるという画期的データがでました。
しかし、先ほど述べましたように副作用が強いようです。また、これらの結果は全て欧米人のものですので、日本人でどのような効果、どのような副作用が起こるかということを明確にする必要があると思われます。
*4 臨床試験の参加方法
新しい薬剤や新しい治療法について臨床試験が計画されている場合、通常は担当医から患者さんに「臨床試験に参加しませんか?」と同意を求められます。それに参加していただく大前提は、あらかじめ協力を求める患者さんに対する詳しい説明と、それを十分に納得してもらうことです。
「何を目的とした試験か」、「薬をどういうふうに使うか」、「どういう検査をするか」、「どういうスケジュールで行うか」、「どういう副作用が考えられるか」、「どういう効果が期待できるか」、「副作用で被害を受けたとき、どのような補償を請求できるか」、「治験に参加しない場合どういう治療法があるか」、「途中で副作用がつらい、自分には合っていないと思ったら、いつでもやめられる」といった説明がなされます。
また、これらのことを文書にした「説明同意文書」というものが必ず渡されるので、これらをよく読んで理解して、同意の自筆署名をします。
臨床試験というと、何か実験されているような感じがするかもしれませんが、多くの薬剤が外国ですでに使われているものを日本人にも安全に使えるかどうか、効果があるかどうかを確かめるために行われています。多くの薬剤は、この試験を通して日本にも導入されます。
そのため、これら臨床試験に参加することで、外国で使用されながら日本では投与できない最新のがん治療薬を用いた治療を受けることも可能になると思われます。このような点も十分考えて、臨床試験に参加するかどうか決めていただければいいと思っています。
*5 ネクサバールの副作用
ネクサバールの副作用としては、全身倦怠感・脱力、高血圧、発疹、下痢など消化器症状、手足の有痛性水泡性病変などがあります。
しかし、現在までに報告された結果を見る限り、スーテントに比べると副作用は比較的軽いようです。
もちろん、これら分子標的薬は予期しない合併症が起こる可能性があるため、ネクサバールにおいても十分な注意が必要です。
*6 新しい分子標的薬
今回ご紹介したネクサバールやスーテント以外にも、いくつかの新しい薬剤が開発されつつあります。
そのうち、mTOR阻害剤といわれるテムシロリムスは、ASCO2006において、よりたちの悪い腎臓がんで有効と報告されていますし、RAD001という薬も臨床的に使えるようになりつつあります。現在、これら分子標的薬の開発、研究が急ピッチで進んでおり、期待されるところです。
同じカテゴリーの最新記事
- 肝がんだけでなく肺・腎臓・骨のがんも保険治療できる 体への負担が少なく抗腫瘍効果が高いラジオ波焼灼術
- 分子標的薬と免疫療法薬との併用療法が高い効果 進行腎細胞がんの1次治療に新しい複合免疫療法が登場
- 症例を選択すればTKI単独療法でも十分に対応可能! 転移性腎細胞がん中リスク群での一次治療に対する治療薬選択
- 初期治療から免疫チェックポイント阻害薬選択の時代へ 腎細胞がん治療はここまで来た!
- 腎盂・尿管がんの最新治療 再発・進行がんに免疫チェックポイント阻害薬も標準治療に
- 増えているロボットによる腎がん部分切除 難しい腎がん部分切除を3DとVR技術を使ってより安全に
- 免疫チェックポイント阻害薬で完治の可能性も 腎がん薬物療法の主役は、分子標的薬から免疫チェックポイント阻害薬へ
- 腎細胞がんで免疫チェックポイント阻害薬が承認され、治療選択の武器が増える
- ハイクオリティ・ローコストの先端型ミニマム創内視鏡下無阻血腎部分切除術


