バイオマーカーをよく理解し、より効果的な治療を受けよう 個別化治療を推し進める肺がんのバイオマーカーとは?
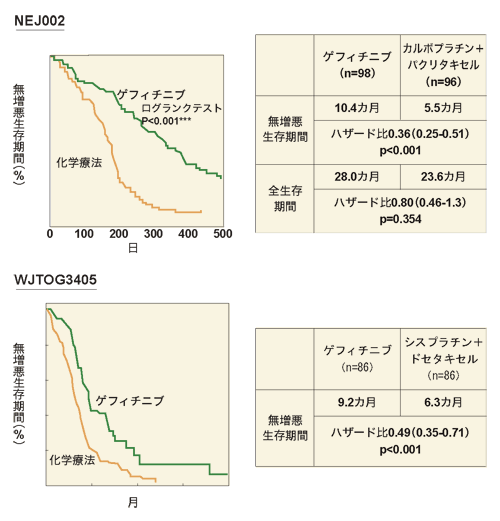
イレッサの登場で患者の寿命も延びた
イレッサの登場により、進行・再発の非小細胞肺がん患者全体の寿命も延びている。
イレッサが発売される前、進行した非小細胞肺がんで従来の抗がん剤治療を行った場合、生存期間の中央値は12~15カ月だった。それに対し、進行した非小細胞肺がんで、EGFR遺伝子変異のある患者にイレッサを使うことによって、生存期間の中央値は25カ月になった。おおよそ1年長いのだから、大きな違いといえるだろう。
ただし、問題もある。それは「治療の順番」が確立していないことだ。
「最初にイレッサを投与するのがよいか、それとも、従来の抗がん剤治療を先に行って、がんが増悪した場合にイレッサを投与するのがよいか、この点についてはまだわかっていません。先にどの治療を受けるかは、そのときの患者さんの状況にもよるでしょう」(山本さん)
イレッサは、間質性肺炎などの重篤な副作用もあるが、従来の抗がん剤に比べて副作用が少ない。そのため、働きながらがん治療を行う患者にとっては、従来の抗がん剤に比べて服用しやすいと言えるだろう。一方、治療に専念できる人は、従来の抗がん剤をまず使い、そのあとに副作用の比較的少ない、イレッサといった薬剤を用いるという選択肢もある。つまり、個々人の生活の状況も考慮して、薬剤を選択することが必要といえそうだ。
一方、肺がんの治療に使われる分子標的薬には、イレッサのほかに、タルセバ(一般名エルロチニブ)もある。タルセバも、イレッサと同じ、EGFR遺伝子変異のある患者に効果があることがわかっている。
タルセバの治療効果について、山本さんは「EGFRの遺伝子変異のある患者さんには、イレッサと同程度に効くことがわかっています」と話す。
ただし、患者のなかには、EGFRの遺伝子変異のない人でもタルセバが効く場合もあり、タルセバとEGFR遺伝子との関係について、詳細にはまだわかっていないという。
イリノテカンの副作用ともう1つのバイオマーカー
肺がんのバイオマーカーのもう1つの主役、UGT1A1について見てみよう。肺がんの患者などにイリノテカン(商品名カンプト、またはトポテシン)を投与すると、肝臓で代謝されたり、腎臓で排出されたりして、毒素は体外へ出ていく。このイリノテカンの薬物代謝の過程で、最も重要な酵素がUGT1A1と呼ばれる酵素だ。
UGT1A1の遺伝子に異常があると、酵素がうまく働かずに、SN38と呼ばれるイリノテカンの活性代謝物が解毒されずに残るため、副作用が多く出る。イリノテカンの副作用で最も問題になるのは下痢、そして好中球減少といって、白血球の一種である好中球が減少し、感染症にかかりやすくなることがあげられる。
UGT1A1は血液検査で行う。検査費用はEGFRの遺伝子変異検査と同様で、自己負担は6000円程度だ。
遺伝子変異の有無が好中球減少に影響
| イリノテカン単剤 | 人数 | グレード3/4 好中球減少 |
|---|---|---|
| -/- | 3/21 | 14.3% |
| +/- | 7/29 | 24.1% |
| +/+ | 4/5 | 80.0% |
| シスプラチン+ イリノテカン | 人数 | グレード3/4 好中球減少 |
| -/- | 20/35 | 57.1% |
| +/- | 14/20 | 70.0% |
| +/+ | 7/7 | 100% |
UGT1A1に関与する2つの遺伝子のうち、両方に変異があると、イリノテカンを投与した場合、UGT1A1の活性はかなり下がることがわかっている。その結果、好中球が減少する副作用は80パーセントほど出るようになる。一方、2つの遺伝子ともに変異がない場合、好中球が減少する割合は14・3パーセントとかなり低い。
また、イリノテカンとシスプラチンを併用した場合は、2つある遺伝子の両方に変異があると、ほぼ100パーセント、好中球は減少する。2つの遺伝子ともに変異がない場合、好中球が減少するのは57・1パーセントである。
これらのデータから、UGT1A1の遺伝子変異の有無が好中球減少の頻度や現れ方に大きな影響を与えていることがわかる。
変異のある人には十分なモニタリングを
では、UGT1A1の遺伝子変異のある人へのイリノテカンの投与は、どうすればいいか? 他のがん種だが、投与量に関して、興味深い結果が出ている。
大腸がんや胃がんの患者を対象にして、UGT1A1遺伝子の変異を起こしている人とそうでない人にイリノテカンを投与。適切な投与量を調べる臨床試験が行われた。
その結果、UGT1A1に関与する2つの遺伝子のうち、両方ともに変異がある場合、承認されているイリノテカンの用量150ミリグラム/平方メートルでは、投与量が多すぎることがわかったのだ。
「好中球減少や下痢といった症状を訴える患者さんの割合は、遺伝子変異がない人に比べて、変異がある人に多い結果となりました。試験から、UGT1A1に関与する2つの遺伝子のうち、両方ともに変異がある患者さんでは、開始用量の減量や慎重な観察をする必要があると結論づけられています」
血液毒性
| 好中球減少 | ワイルド群 n=41 (グレード3/グレード4) | ヘテロ群 n=16 (グレード3/グレード4) | ホモ群 n=16 (グレード3/グレード4) |
|---|---|---|---|
| 1サイクル | 9.8%(4/0) | 18.8%(3/0) | 62.5%(4/6) |
| 2サイクルまで | 22.0%(9/0) | 25.0%(3/1) | 81.3%(6/7) |
非血液毒性
| 下痢 | ワイルド群 n=41 (グレード3/グレード4) | ヘテロ群 n=16 (グレード3/グレード4) | ホモ群 n=16 (グレード3/グレード4) |
|---|---|---|---|
| 1サイクル | 0.0%(0/0) | 0.0%(0/0) | 6.3%(1/0) |
| 2サイクルまで | 0.0%(0/0) | 0.0%(0/0) | 6.3%(1/0) |
ワイルド群=変異なし群、ヘテロ群=UGT1A1に関与する2つの遺伝子のうち1つが変異、ホモ群=UGT1A1に関与する2つの遺伝子のうち2つとも変異
一方、肺がん治療に用いられるイリノテカンの量は、大腸がんや胃がんより少なく、現在、単剤でも100ミリグラム/平方メートル。「肺がんの場合、今のところ遺伝子変異を調べて、イリノテカンの投与量を調節したほうがいいかは、十分わかっていない」(山本さん)のが現状のようだ。
ただ、山本さんは言う。
「イリノテカンを使わないといけないのだけれども、強い副作用が出たときに患者さんがその副作用に耐えられそうにない場合には、前もってUGT1A1の遺伝子の異常を調べて、治療中のモニタリングを十分行っていく必要があると思います」
肺がんの治療に関するバイオマーカーの研究は日進月歩である。たとえば、分子標的薬であるアバスチン(一般名ベバシズマブ)や、非小細胞肺がんのうち、非扁平上皮がんによく効くアリムタ(一般名ペメトレキセド)について、現在バイオマーカーとの関係を調べた研究が急ピッチで進められている。
バイオマーカーの研究が進むことで、肺がんの個別化治療がさらに進むことを期待したい。
同じカテゴリーの最新記事
- 手術後の再発予防に加え、Ⅲ期の放射線化学療法後にも EGFR変異陽性肺がんタグリッソの治療対象さらに広がる!
- 有効な分子標的薬がなかったEGFRエクソン20挿入変異陽性肺がんに ついに承認された二重特異性抗体薬ライブリバント
- 薬物療法の進歩で対象となる患者が増えている! 非小細胞肺がん4期からのサルベージ手術
- 薬物療法は術前か、それとも術後か 切除可能な非小細胞肺がん
- Ⅳ期でも治癒の可能性が3割も! 切除不能非小細胞肺がんの最新治療
- 肺がん治療の最新トピックス 手術から分子標的薬、免疫チェックポイント阻害薬まで
- 遺伝子変異を調べて個別化の最先端を行く肺がん治療 非小細胞肺がんのMET遺伝子変異に新薬登場
- 分子標的薬の使う順番の検討や併用が今後の課題 さらに進化している進行非小細胞肺がんの最新化学療法
- 肺がんⅢ期の化学放射線療法後にイミフィンジが効果 放射線副作用の肺臓炎をいかに抑えるかが重要
- 体重減少・食欲改善の切り札、今年いよいよ国内承認か がん悪液質初の治療薬として期待高まるアナモレリン


