- ホーム >
- 薬 >
- 免疫チェックポイント阻害薬
「免疫チェックポイント阻害薬」の前に、「免疫」の精巧な仕組みを知ろう 「免疫チェックポイント阻害薬」の現状と将来展望を紐解く
「免疫チェックポイント阻害薬」の現状と将来展望を紐解く
免疫が、複雑、かつ精巧な仕組みをもって、我々の体を守っていることを理解いただいただろうか。その免疫システムを活用して、人は「がん」に挑んだ。そして、「免疫チェックポイント阻害薬」という1つの確かな成果を出したのだ。
では、「免疫チェックポイント阻害薬」の実像と今後の展望に迫りたい。
免疫チェックポイント阻害薬の仕組みを知る
いよいよ、数あるがん免疫療法の中から一気に飛び出した「免疫チェックポイント阻害薬」の正体を明らかにしよう。
獲得免疫のT細胞には、抗原提示細胞から異物情報を受け取って攻撃指令を出す「CD4+ヘルパーT細胞」と、実際に異物を攻撃する「CD8+キラーT細胞」があるが、実は、司令塔の「CD4+ヘルパーT細胞」と同じようにCD4を発現するT細胞には、攻撃だけでなく制御の機能を担う細胞がある。CD8+キラーT細胞が正常細胞にまで過剰攻撃しないよう歯止めをかけたり、異物を排除し終えたら獲得免疫を消滅させて免疫反応を終了に導いたりするのが制御機能で、その働きをするCD4+T細胞を「制御性T細胞」と呼ぶ。
制御性T細胞に加えて、免疫システムの活性化をストップさせるシグナル(共抑制)を伝える分子が免疫チェックポイント分子と呼ばれるPD-1やCTLA-4。PD-1やCTLA-4は受容体でT細胞上にある。それら受容体に「活性化せよ(攻撃ストップせよ)」という共抑制シグナルが送られると、T細胞は異物攻撃を止めてしまうわけだが、がん細胞はその仕組みをうまく利用して免疫システムに抑制シグナルを送り、T細胞の攻撃をかわしていたことが判明したのだ(図3)。
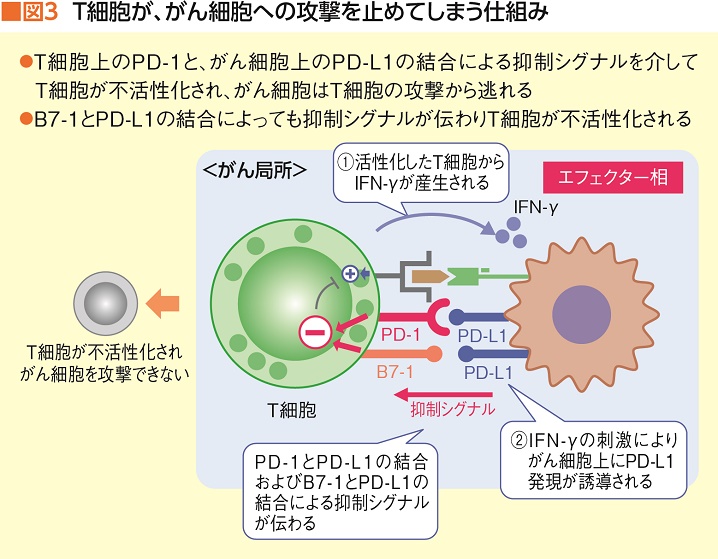
そこに登場したのが免疫チェックポイント阻害薬。がん細胞がPD-1受容体やCTLA-4受容体に働きかけて免疫機能を遮断する前にT細胞にアプローチし、異物攻撃を止めないよう誘導することに成功した。ちなみに、PD-1にシグナルを受け取れないようブロックするのが、オプジーボや*キイトルーダ。そして、CTLA-4をブロックするのが、悪性黒色腫(メラノーマ)に適応されている*ヤーボイだ。
日本では抗PD-1抗体のオプジーボが最初に承認されたが、世界的には抗CTLA-4抗体のヤーボイが先に承認。その後、同じく抗PD-1抗体のキイトルーダが承認され、さらに現在、PD-1と合体して共抑制を発するがん細胞側のPD-L1を遮断する抗PD-L1抗体の*テセントリクが肺がんで申請中(メルケル細胞がんでは2017年9月承認)。近いうちに承認される見込みだという。
承認されたとはいえ、がん種は限られている。現在、最も広く適応されているのは*オプジーボ。悪性黒色腫(2014年7月承認)、小細胞肺がん(2015年12月承認)、腎細胞がん(2016年8月承認)、ホジキンリンパ腫(2016年12月承認)、頭頸部がん(2017年3月承認)、胃がん(2017年9月承認)で適応されており、今後も各種がんに適応拡大していくそうだ。
「なぜPD-1シグナルをブロックするオプジーボが様々ながん種で用いられているかというと、PD-1が、免疫が弱ってきたとき最初に使われる共抑制(免疫ストップせよ)シグナルの伝達分子だからです。つまりT細胞が最初に用いる免疫チェックポイント分子だからこそ、PD-1を遮断することで効果が出る人が多いのです」
オプジーボに効果ありとなしの違いとは
〝自身の免疫で、がんをやっつける!〟と思うと、夢の治療法のように思うが、実は現時点でのオプジーボ奏効率は、全投与患者数の2割から3割ほど。つまり、効果がないケースのほうが圧倒的に多いという現実がある。効果が表れないのはなぜか。
「免疫逃避を促す機構(免疫抑制機構)はPD-1だけではなく、いくつも存在するのです。ですから、患者さんのT細胞の中にはPD-1分子だけでなく、ほかにも様々な共抑制の伝達分子(免疫チェックポイント分子)を使っているT細胞がいて、その場合はPD-1を遮断しただけでは効果が出ないこともあります。
また、がん細胞は賢いから、PD-1をブロックされたら、他の免疫抑制機構を使おうとも考えるわけです。だからこそ、PD-1だけでなく、LAG-3、TIM-3といった新たな免疫抑制機構をターゲットにした免疫チェックポイント阻害薬の開発が急がれているのです」
さらに、もう1つ、別の要因が考えられる。
「免疫が攻撃できないようブロックがかかっている場合、その活性化を遮断すれば免疫が再びがん細胞を攻撃するようになり、治療効果が現われると考えるわけですが、前述のように、がん細胞そのものが遺伝子変異を繰り返す中で、異物から自己もどきに変貌していることがあるのです。
その変貌ぶりが見事で、免疫系に遺物の情報を伝えるHLAを表出しなかったり、ほとんど自己に近いものになってしまっている場合、いくらPD-1を遮断して免疫ががん細胞を攻撃できるようになっても、免疫系が、がん細胞が「異物である」と認識できなかったり、「自己である」と認識してしまったら攻撃はしません。そうなると、がん細胞にとって、免疫が働き始めても痛くも痒くもないのです」
というわけで、現在、オプジーボで効果が表れない理由として考えられるのは、使っている免疫抑制機構がPD-1ではない場合、もしくは、PD-1以外にも複数の免疫抑制機構を使っている場合、そして、がん細胞自身が限りなく「自己」に近づいてしまっている場合、ということになる。
先の2つに関しては、今後出てくるであろうLAG-3など別の免疫抑制機構をターゲットにした免疫チェックポイント阻害薬の使用や併用、もしくは、化学療法や分子標的薬との併用療法が考えられると西川さんは言う。ただ、難しいのは、がん細胞が限りなく「自己もどき」に変貌し、免疫系が「自己である」と認識してしまう場合だ。
「この場合は、まったく別のアプローチが必要になります」と西川さん。自己に対する免疫というものがあって、本来起こすべきではないものを起こす、という機序になるため、副作用も予想がつかず、現在は研究段階だそうだ。
逆に、オプジーボに効果を見せるがんは、どういう状態なのだろうか。
「免疫抑制をたくさん取り込んで成長してきたがんは、がん自体は遺伝子変異の多い異物のままです。そういうがんなら、免疫抑制を外しさえすれば、異物だから、免疫システムは、がん細胞を攻撃し始めるのです。つまり、オプジーボがよく効くわけです」
がん細胞は1人ひとり全く違う。遺伝子変異の状況はもちろん、その変異に対して免疫機構が「異物である」と判断しているのか、「自己である」と判断しているのか。さらに、異物と判断しているにも関わらず免疫による攻撃が遮断されているとしたら、使われているシグナル伝達分子はPD-1なのか、それ以外なのか、など。
現在の医療ならば、がん細胞の検体から免疫状態を解析すれば、かなりの情報が得られるそうだ。とはいえ、1人ひとりのがん細胞をすべて解析するのは物理的に不可能だ。そこで今、個々のがん細胞の免疫状態を把握できるバイオマーカーの開発が急ピッチで進められているという。
「近い将来、あなたはPD-1だけで行けます、あなたはLAG-3などの別の免疫チェックポイント分子に対するブロックが必要です、もしくは、PD-1とLAG-3両方出ているから併用で行きましょう、といった診断が可能になる日が来るでしょう。もっと言うと、あなたはがん細胞が持っている発がん遺伝子シグナルが邪魔しているので、分子標的薬の併用で行きましょう、ということになると思っています」
化学療法、分子標的薬との併用の可能性
さらに、今後は、化学療法との併用も大いにあるとのこと。
「抗がん薬の中には、免疫チェックポイント阻害薬と併用していいものと悪いものがあります。なぜなら抗がん薬によってがん細胞の死に方が全く違うからです。免疫にしてみたら、戦国武将のように派手に死んでくれたほうが気づきやすいわけです。変なヤツがいるぞ! ということで食べに行って記憶し、免疫システムの活性化の流れに乗り、いっきに攻撃に至ります。
つまり、何らかの理由で、今まで免疫システムに気づかれずに大きくなったがんを、免疫システムが気づく可能性ができるのです。反応できなかったものが反応できるようになる、という意味で、化学療法との併用は大いにあると思います。でも逆に、静かに死なれたら免疫システムは気づかない。そういう視点からも今、併用可能な抗がん薬を研究しているところです」
華々しくがん細胞を殺せる抗がん薬を選ぶことに加え、もう1つ気を付けなくてはいけないことは、抗がん薬の中には、がん細胞だけでなく、免疫細胞も殺してしまうものがあることだ。つまり、免疫細胞にあまり影響を与えず、かつ、がん細胞を派手に殺してくれる、そういう抗がん薬が、免疫チェックポイント阻害薬との併用療法には適しているとされ、治験も進んでいるそうだ。
分子標的薬についてはどうだろうか。
「分子標的薬は、実はすでに免疫機構に関係していることが非常に多い」と西川さんは指摘する。
たとえば、CML(慢性骨髄性白血病)の治療薬である*グリベックは効果が高いことで知られているが、その影には免疫の働きがあるというのだ。
「グリベックはメインターゲットの慢性骨髄性白血病の原因遺伝子であるBCR-ABL以外にも、LCK(リンパ球チロシンキナーゼ)も阻害します。このLCKが、実は免疫システム、とくにT細胞にとって非常に重要で、最初に抗原情報を認識したときに動き出すシグナルなのです。
それを止められるわけですから、免疫系にとっては甚だ困る事態なのですが、非常に驚いたことに、CMLを治療しようと人が服用しているグリベックの服用量が偶然、キラーT細胞やヘルバーT細胞などの攻撃する側のT細胞には影響を与えず、抑制する側の制御性T細胞だけを止める量だったのです。これは、すごい偶然としか言いようがありません。実際、グリベックがよく効いている人は、制御性T細胞が減っています」
グリベックは稀な幸運例だが、そういう視点で分子標的薬を見ていくと、効果が高い分子標的薬では、ほぼ免疫が活性化している、と西川さんは指摘する。逆に、あまり効かない分子標的薬は、免疫抑制をかけてしまっていることが多いそうだ。
「グリベックに効果がある人は、服用を中止してからも半分程度の患者さんに効果が持続します。これは免疫システムによる抗がん効果と考えられます。免疫は、記憶するシステムですから」
関連深いことが間違いなさそうな免疫チェックポイント阻害薬と分子標的薬。併用についても現在治験が進んでおり、今後、両者の関係性が併用療法という形で明らかにされていくことだろう。
既存のがん治療法と一線を画す理由
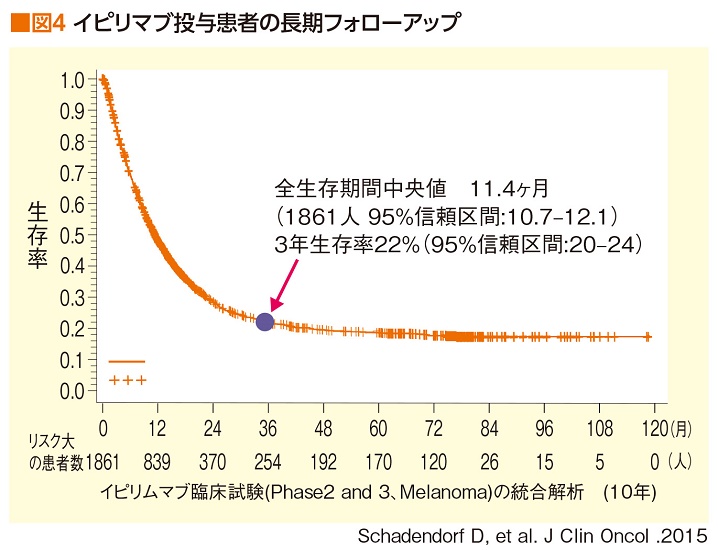
免疫チェックポイント阻害薬によるがん治療を考えるとき、医療従事者も患者本人も、ある意味、頭を切り替えなくてはいけないのかもしれない(図4)。
「これまでの殺細胞性の薬物療法は、例えて言うならば、ボタンを押し続けている間は効くけれど、ボタンから手を離したら効かなくなる、というものでした。ところが、免疫システムは仕組みが全く違い、あるレベルまで活性化したら細胞に記憶されるのです。そうなると、ボタンから手を離しても効いている、つまり、投与を止めることができる日がくるのです。これは〝進行がんが治癒した〟ことを意味すると言っていいでしょう」
ただし、現時点では、それは全員で起こるわけではなく、免疫でコントロールできる性質のがん細胞の場合に限られる。併用療法がまだ承認されていない現状では、免疫チェックポイント阻害薬は単剤投与しか方法がなく、現状では、総投与数に対して2~3割の奏効率。とはいえ、今後、バイオマーカーが確立し、1人ひとりのがん細胞の免疫状態を把握できるようになれば、加えて、様々な併用療法が適用されるようになれば、奏効率もグッと上がることだろう。
遺伝子解析の進歩で分子標的薬の個別化医療が可能になったように、免疫チェックポイント阻害薬にも個別化医療が実現する日が遠からずやってくることを期待したい。進行がんが治癒するのは、そう遠い先のことではないのかもしれない。
*商品名キイトルーダ=一般名ペムブロリズマブ *商品名ヤーボイ=一般名イピリムマブ *商品名テセントリク=一般名アテゾリズマブ *商品名グリベック=一般名イマチニブ
同じカテゴリーの最新記事
- 免疫チェックポイント阻害薬との併用療法で大きく前進 新たな進行期分類が登場した子宮体がんの現在
- 免疫チェックポイント阻害薬で治療中、命に関わることもある副作用の心筋炎に注意を!
- キイトルーダ登場前の時代との比較データから確認 進行性尿路上皮がんの予後が大幅に延長!
- 肺がんに対する免疫チェックポイント阻害薬の治療効果は腸内細菌が関係!
- 複合がん免疫療法が、がん薬物療法の主力に! 免疫療法の個別化医療を目指す
- 胃がん新ガイドライン「条件付き承認」で増える治療選択 1次治療でオプジーボ承認
- 乳がん治療にも免疫チェックポイント阻害薬が登場! トリプルネガティブ乳がんで承認、さらに――
- 初期治療から免疫チェックポイント阻害薬選択の時代へ 腎細胞がん治療はここまで来た!
- 患者にもわかりやすく明確化された推奨する治療・しない治療 全面改訂された「大腸癌治療ガイドライン」2019年版


