がん医療の総帥に聞く! 新しい薬・適応外の治療をもっと早く、患者さんのもとへ
初期の臨床開発を担い日本発の創薬に貢献

早期・探索臨床研究センターは、築地の中央病院と研究所、柏の東病院と臨床研究センターの、2つの病院と2つの研究施設が合同で運営し、連携しながら研究・治験を行っている
――具体的な進捗状況についてお聞かせください。
堀田 1つ目の早期・探索臨床研究センターについては、すでに一昨年9月の組織改編で東病院と中央病院との双方に設置しています(図2)。これにより、世界中から薬のシーズを集め、有望なものを目利きして薬剤開発につなげるための仕組みが整備できたわけです。
――日本では米国と比べると、臨床試験や薬剤開発のスピードが遅いと言われています。早期・探索臨床研究センターの創設によって、その遅れを取り戻すことができるのでしょうか。
堀田 日本では医学の基礎研究のレベルは高く、創薬に結びつくタネは豊富にあるものの、それが臨床に結びつかないのが課題だと言われ続けてきました。基礎研究と創薬の間に「深い谷」があり、そこで足踏みしているうちに、海外の製薬企業が新薬を開発してしまう。「日本では創薬産業が育たない」といわれるゆえんです(図3)。
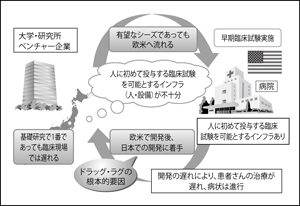
(厚生労働省資料「早期・探索的臨床試験拠点整備事業について」より)
基礎研究の成果を創薬に活かすためには、薬の最適化や安全性を見るフェーズⅠ試験が豊富に行われる必要があります。しかし、大手製薬企業は、商品化できるかどうかもわからない段階で、巨額の投資をするようなリスクは冒せない。米国では、一獲千金を狙う創薬ベンチャーがその役割を担っていますが、ビジネス環境が異なる日本ではそれも難しい。
そこで、この問題を解消するべく、国は昨年「創薬支援ネットワーク」を発足。2020年までに日本発の革新的な医薬品を創出することを目指し、オールジャパンの支援体制を作りました。我々も「早期・探索臨床研究センター」を拠点として初期の臨床開発を担い、できるだけ早く創薬に結びつけたいと考えています。
民間と協力しがん情報の普及に努める

生命保険会社、製薬会社と協力して配布した、がん啓発のパンフレットやポスター
――「がん医療の均てん化」や「医療情報の提供」についてはいかがでしょうか。
堀田 現在、全国の拠点病院で標準的治療が行えるようにするため、研修やガイドラインの整備を進めています。
それに加えて、患者さんにがんの医療情報を届けるための仕組み作りも重要です。これまで、患者さんへの情報伝達は、医療機関が中心になって行ってきました。しかし、この方法では、社会の隅々まで情報を行き渡らせることはできない。そこで始めたのが、生命保険会社、製薬会社など民間企業との提携です(図4)。
民間企業の顧客ルートを活用すれば、患者さんだけでなく一般市民の皆さんにも、がんに関する情報を浸透させることができる。そこで、生命保険会社や製薬会社と協力して、がんの啓発を目的としたパンフレットを配布してもらう体制を整えました。
さらに、大阪・堺市立健康福祉プラザの点字図書館と連携して、点訳・音訳サービスによる医療情報の提供も始めています。このように、健常者や障害のある人も含めて、情報を社会の隅々まで届けるための取り組みを進めているところです。
適応外薬が早く使える近道をつくる
――さきほどの新薬の開発に通じる話ですが、がん治療における課題の1つに、日本では欧米よりも薬剤の承認が遅れるという「ドラッグ・ラグ」の問題があります。このギャップを解消するためには何が必要ですか。
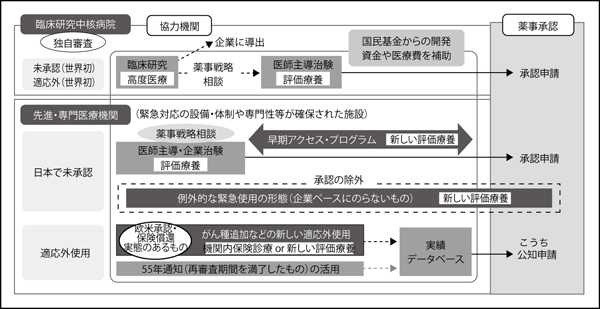
堀田 ドラッグ・ラグの問題については、国もただ手をこまねいていたわけではありません。2010年、国は学会などに呼びかけて、「海外で承認された未承認薬や保険適応外の薬剤のうち、ニーズが高く早期導入が望まれる薬」についての要望を集めました(注1)。こうして集まった要望のなかから374品目を選び出し、最終的に186品目まで絞り込んで、少しでも早く患者さんの治療に使える対策を検討したのです。
ただし、未承認薬の場合は、日本人を対象とした臨床試験を行うことが大原則です。そのためには、開発元の製薬企業の協力が欠かせません。そこで厚生労働省では、製薬企業にさまざまなインセンティブを提供しながら、早期の商品化に向けて取り組みを進めています(図5)。
――医薬品を承認内容に含まれない方法で使用する「適応外処方」についても、臨床試験の実施が義務付けられており、ドラッグ・ラグを生み出す一因となっています。
堀田 適応外のものについては、現在の法体系を弾力的に運用すれば、必ずしも治験を行う必要はない、というのが僕の考えです。このような医薬品のなかには、すでに日本人に対する安全性が証明されているものも多い。こうしたケースは、公知申請(注2)で十分に対応できます。
なぜなら、1980(昭和55)年に厚生省から出された「55年通知」があるためです。これは、「保険適応外でも有効性や安全性が確認されている医薬品にかぎり、医師が必要と判断した場合は、個別のレセプト審査に基づき、保険請求できる」としたものです。この55年通知を拡大解釈することにより、がん対策基本法が施行された2007年より、特定の抗がん薬については、適応外でも保険診療が認められるようになりました。つまり、公知申請や55年通知を弾力的に利用すれば、わざわざ新しい法律を作らなくとも、適応外の抗がん薬を保険診療下で使うことができる。この前提に基づいて、より柔軟な医薬品処方の実現に向けて国に働きかけているところです(図6)(注3)。
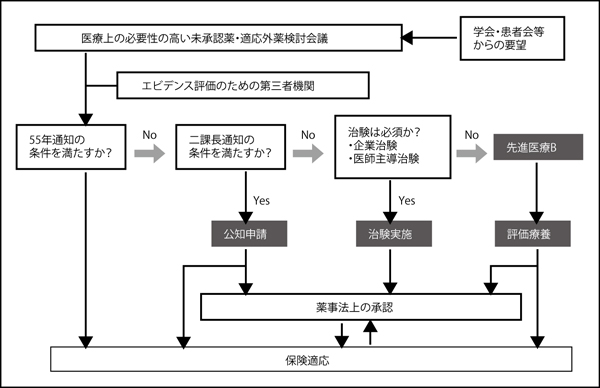
注1=厚生労働省の「医療上の必要性の高い未承認薬・適応外薬検討会議」による試み
注2=「公知申請」とは、すでに承認された医薬品の適応外処方について、科学的根拠により効果・効能が世間に広く知られている場合は、臨床試験の全部もしくは一部を実施しなくとも承認が可能とする制度
注3=「日本版コンペンディア(医薬品処方方針)」という


