アバスチン、サリドマイド他、複数の治験が進行中 注目の血管新生阻害剤
分子標的治療のための新しい血管新生阻害剤
大腸がんなどに効果が期待されているアバスチン
分子標的薬として開発された血管新生阻害剤は、一般的に(1)耐性獲得(投与を続けるうちに薬が効かなくなること)が少なく、(2)がんの種類に関わらず比較的均等な効果を持ち、(3)副作用が軽微、と考えられていた時代があります。しかし、臨床試験などが進むにつれて、実際には耐性獲得が認められることもあれば、がん種や時期によっては効果が異なることもあり、また、薬剤固有の注意すべき副作用があることなどもわかってきました。
例えばアバスチン(一般名ベバシズマブ)では、大腸がんに対する効果が他のがん種よりも高いのではないかと言われています。また、SU5416という血管新生阻害剤では早期膵臓がんに有効だが、進行がんには無効、逆にSU6668という血管新生阻害剤では早期がんに無効だが、進行がんには有効と報告されたこともあります。ですから、血管新生阻害剤をひとくくりに考えるのは、なかなか難しいようです。
さて、分子標的薬として開発され、治験進行中の血管新生阻害剤はたくさんありますが、その中でも米国にて迅速に治験が進められ、すでに臨床使用が可能な薬剤として「アバスチン」を挙げることができます。この薬剤は、前述のVEGF(血管新生を指令する物質の1つ)と結合するモノクローナル抗体製剤であり、従来の抗がん剤への上乗せ効果に優れることから、世界中の注目を集めています。研究者の一部からは、「がんの中にある血管を、アバスチンが正常な血管構造に近づけることで、併用する抗がん剤が浸透しやすくなるのではないか」といった意見も聞かれます。日本でも近い将来、承認される見込みだとの話があり、目下のところ一番話題になっている薬剤でもありますから、ここではアバスチンに関する最近の治験動向をご説明しましょう。
アバスチンで最も早くに治験が進んだのは、大腸がん(結腸・直腸がん)です。何故なら、大腸がんでは高頻度にVEGFを発現しており、そのため他のがん種よりも優れた効果が期待されたからです。ちなみに、がんの治験は進行患者(再発・転移例)から始まって、最終的に早期患者(初発・未治療例)の検討で終了���るのが一般的です。アバスチンでも、その順序で治験が進行しており、すでに転移後の1次療法として米国FDA(食品医薬局)の承認を得ています(2004年2月)。
アバスチンの主な第3相試験には、IFLにアバスチンを加えた試験と、FOLFOXにアバスチンを加えた試験の2つが有名です。(注:IFLとはイリノテカン、5-FU、ロイコボリンの3剤併用。FOLFOXとは、オキサリプラチン、5-FU、ロイコボリンの3剤併用)
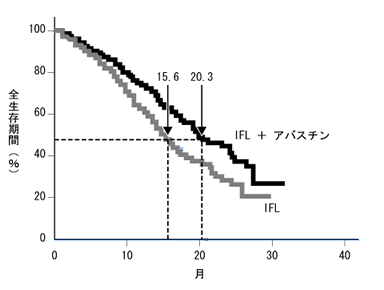
各々の結果を要約すると、未治療の転移性大腸がんに対してIFL+アバスチンを投与した結果、IFLだけの場合と比べて約5カ月の生存期間延長(図4)と約4カ月の無増悪生存期間延長が認められました。前治療歴を有する進行性大腸がんに対してFOLFOX+アバスチンを投与した結果でも、FOLFOXだけの場合と比べて明らかな延命効果が実証されました。副作用面では、アバスチンを上乗せすることで高血圧や神経障害が若干増加する傾向にありましたが、全体として重篤な副作用が増えるといった印象はないことから、アバスチンの上乗せは安全に行えるものと考えられました。製薬会社はこうした良好な結果を受けて、術後補助療法(手術後に残存するがん細胞を抗がん剤で死滅させ、再発を防止しようとする治療法)にも適応を拡大していくために、治験を続ける予定だそうです。
アバスチンは、肺がんの治験においても良好な結果が得られています。その主なものとして、昨年の米国臨床腫瘍学会(ASCO2005)で発表された第3相試験結果をご紹介しましょう。進行した非小細胞がんに対してカルボプラチン+パクリタキセルにアバスチンを加えた3剤併用療法の成績です。先立って行われた第2相試験では致命的な喀血が9パーセントの患者さんに認められたことから、この第3相試験では扁平上皮がんの患者さん、血痰の多い患者さん、脳転移のある患者さんが治験対象から除かれました。
試験の結果、腫瘍が半分に縮小した患者さんの割合は、アバスチンを加えない場合に10パーセントだったものが、アバスチンを加えることで約3倍の27パーセントに増加しました。全生存期間と無増悪生存期間は、各々で約2カ月間延長しました。副作用については、アバスチンを加えることで好中球減少と血小板減少が高頻度にみられましたが、懸念された喀血は4.5パーセントに減少していました。
さらにアバスチンでは、未治療の転移性乳がんに対する第3相試験が進められており、従来の抗がん剤との併用で得られた成績が、近く開催される国際会議にて発表される予定です。現在までの試験成績をみるところ、アバスチンはおそらく多剤併用療法の名脇役になることでしょう。
温故知新の血管新生阻害剤

多発性骨髄腫の治療薬として
注目を集めることになったサリドマイド
先に述べたとおり、血管新生阻害剤としては開発されなかったにも関わらず、後の研究によって血管新生阻害作用をみいだされた薬剤が複数存在しています。その中の代表格がサリドマイドです。初期の血管新生阻害剤は思ったほど効果がなく、研究熱が下火となりかけたちょうどその時代に、サリドマイドの血管新生阻害作用と臨床効果が認められ、研究が息を吹き返したという経緯もあるのです。
サリドマイドは、奇形児などの悲惨な薬害をもたらして発売中止になった催眠薬ですが、1990年代以降に血管新生阻害作用が確かめられたことで、最近は各種がんへの応用が試みられるようになりました。手足のない赤ちゃんが生まれた原因を振り返ってみると、それはサリドマイドに強い血管新生阻害作用があったからだと考えられます。つまり、胎盤を通して妊婦から胎児へ移行したサリドマイドが、本来活発であるべき胎児の血管新生を阻害し、結果として手足の正常な発育が妨げられたのだと理解できます。
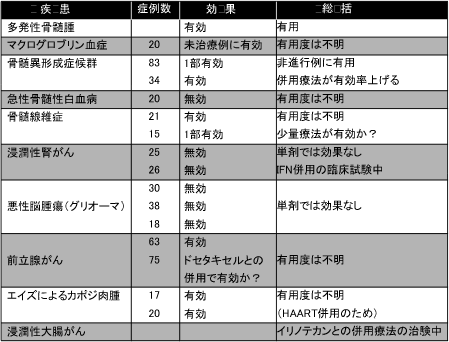
各種のがんや腫瘍性疾患に対して現在までに行われた試験結果を見る限り、サリドマイドは何にでも効く抗がん剤ではないようです(表2)。では、どうして世界中の注目を集めているのでしょうか。それは、難治性骨髄腫に対する優れた効果があるからです。進行例に対して、サリドマイド単独でも30~40パーセントの奏効率(一定以上の効果が認められた患者割合)、副腎皮質ステロイドであるデキサメタゾンとの併用に至っては60パーセント前後の奏効率、生存期間(中央値)は約2年という画期的な成績が得られています。そして現在、さらに良い成績を求めて、様々な抗がん剤との組み合わせが早期患者に対して試験されているところです。そうした臨床研究の一部を、先ごろ行われた米国血液学会(ASH2005)の中からご紹介しましょう。
オーストラリア等の研究グループは、初回治療例に対してサリドマイドとデキサメタゾンを投与したところ、奏効率(NR以上)は73パーセントと極めて高く、奏効までの期間はわずか9週間ほどでした。早期であれば、沢山の患者さんに早く効くといった結果です。一方、イタリア等の研究グループは、同じく初回治療例にアルケラン(一般名メルファラン、骨髄腫の標準薬)とプレドニゾロン、およびサリドマイドを併用した結果、奏効率(PR以上)は76パーセント、無事故生存期間(中央値)は29.2カ月だったと報告しました。まったくの無事故で2年以上暮らせるというのは、今までなかった成績です。フランス等の研究グループも初回治療例を対象にメルファランとプレドニゾロンとサリドマイドを併用して、無進行生存期間(中央値)29.5カ月という結果を報告しました。
残念なことには、サリドマイドを併用することで重篤な副作用が若干増加しており、血栓症や末梢神経障害、および感染症などが問題となっていました。ちなみに、サリドマイドには血管新生阻害作用のみならず、直接的な抗腫瘍効果(腫瘍を縮小させる効果)もあることが最近の基礎研究で明らかにされました。優れた試験成績の背景には、サリドマイドのそうした特性も関係しているのでしょう。
なお、日本では骨髄腫の患者さんによる個人輸入によって、サリドマイドが使用されている実態があり、その件数は増え続けています。厚生労働省はこれに鑑み、サリドマイド使用の安全性を図るため、2004年12月に日本臨床血液学会と共同で、「多発性骨髄腫に対するサリドマイドの適正使用ガイドライン」を定めました。今後は、このガイドラインに従い適切なサリドマイド療法が行われるよう期待されます。また、製薬企業が2005年7月に厚生労働省で会見し、同月から国内で治験を実施すると明らかにしました。治験は2006年3月まで行い、可及的速やかに承認申請を行う予定だそうです。
同じカテゴリーの最新記事
- 有効な分子標的薬がなかったEGFRエクソン20挿入変異陽性肺がんに ついに承認された二重特異性抗体薬ライブリバント
- 手術後の再発予防に加え、Ⅲ期の放射線化学療法後にも EGFR変異陽性肺がんタグリッソの治療対象さらに広がる!
- PARP阻害薬や免疫チェックポイント阻害薬に続く トリプルネガティブ乳がんに待望の新薬登場!
- 免疫チェックポイント阻害薬の2剤併用療法が登場 肝細胞がんの最新動向と薬物療法最前線
- 新薬や免疫チェックポイント阻害薬も1次治療から 胃がんと診断されたらまずMSI検査を!
- リムパーザとザイティガの併用療法が承認 BRCA遺伝子変異陽性の転移性去勢抵抗性前立腺がん
- 免疫チェックポイント阻害薬で治療中、命に関わることもある副作用の心筋炎に注意を!
- SONIA試験の結果でもCDK4/6阻害薬はやはり1次治療から ホルモン陽性HER2陰性の進行・再発乳がん
- dose-denseTC療法も再脚光を ICI併用療法やADC新薬に期待の卵巣がん
- 心不全などの心血管の副作用に気をつけよう! 乳がんによく使われる抗がん薬


