進行大腸がんにおいて 原発部位が左側の患者では生存期間が長い
効果予測因子にも成り得るか
では、この予後予測因子ともなる原発病変部位だが、治療薬選択においてどのような影響を及ぼすのだろうか。はたして効果予測因子に成り得るものなのか。
砂川さんによると、「大腸がんの遺伝子発現の左右差は薬剤感受性の差にもつながるとの知見も集積しており、海外の大腸がん手術症例の切除標本を用いた検討では、右原発巣でBRAF, KRAS, PIK3CAなどの予後不良との関連性が示されている遺伝子の変異・発現頻度が高く、左原発巣ではアンフィレグリン(AREG)やエピレグリン(EREG)の発現、上皮成長因子受容体(EGFR)やヒト上皮増殖因子受容体2(HER2)の過剰発現など、抗EGFR抗体の感受性に関連する遺伝子発現頻度が高いことが示されている」という。
ただし、将来的な見通しについては「原発巣の部位だけで最適な薬剤の組み合わせを選択するためには情報がまだ十分ではなく、患者の背景因子、腫瘍量や数に加えて、原発巣の位置情報を用いることで、総合的に判断する要因の1つとなるというのが、現時点でのコンセンサスだと思います」としている。
日本での治療ガイドラインの現状
もう1点、砂川さんが指摘しているのは、現在、日本で臨床に用いられている大腸癌研究会編の「大腸癌治療ガイドライン」(2016年版医師用)の内容。
「切除不能進行大腸がんに対する化学療法のアルゴリズム」をみると、大腸がん薬物療法のキードラッグ9剤の組み合わせ別に一次治療だけでも6パターンの選択肢が提示されている(今号7月号特集①「個別化医療が進む進行再発大腸がんの治療」での図を参照)。砂川さんは「選択肢は多いが “どの組み合わせがどの患者に優れているか”まではガイドラインに明記できない段階であり、実臨床では患者さんに一番効果のありそうな薬剤の組み合わせを主治医が選んでいるのが現状です」と述べている。
「ただ、これは日本だけの話ではなくて、世界的にも全く同じ状況です。この中から何か選ばなければならないのですが、選ぶ指標はとくにない。こういう患者さんにはこれが一番良いというように、決まっていないのが一番の問題です」
そこに出てきたのが今回の原発部位の左右差の問題。左側は抗EGFR抗体が効きやすいため、例えば左と診断されたら、他剤ではなく抗EGFR抗体を初めに選択するのも一つのやり方。���後、遺伝子解析のデータから導き出された結果をもとに、どの薬剤が一番良いのかが分かる時代が来るのではないかと言われている。
砂川さんは「大腸がんでは肺がんのように、悪性度にかかわるドライバー遺伝子が見つかっておらず、肺がんほどクリアな薬剤投与の方法がまだ確立していない。Ras遺伝子が標準的に測定されていますが、Ras遺伝子では、抗ERGF抗体が効かないくらいしかわかりません。この薬剤を使用したほうがよいというマーカーにはならない。このため、薬剤の特徴・腫瘍の状態・患者さんの状態など、いくつかのファクターを考慮して、一番よさそうなものを絞っていくような形で、プレシジョンメディスン(より適確な医療)を目指すのが現在の大腸がん領域での流れだと思います」としている。
さらに「左右差を入れることにより、何となく絞り込む形にはなる。大がかりな検査が不要で、原発病変部位だけで薬剤選択ができるということで、世界中が注目していま話題となっている背景にはこのような理由があるわけです。ただ、これだけではまだ足りないので、例えば左側で何かしら特有の遺伝子異常があればこれを活用するとか。いま具体的に動いているところです。それがもう少し進んでいくと、こういう選択肢ではなく、あなたにはこれとこれがあるので、こちらの薬剤のほうがいいですよ、と言える時代が来ればよいと思う」と述べている。
より広い観点からの患者対応が可能な欧州臨床腫瘍学会ガイドライン
こうした状況を踏まえて、砂川さんは、現時点での臨床医の参考となるガイドラインとして、2016年に改訂された欧州臨床腫瘍学会(ESMO)の「転移大腸がん患者の管理に対するコンセンサスガイドライン」を挙げている。同ガイドラインの診療アルゴリズム(図3)では、最初に全身状態(PS)の評価により適応を判定。手術、抗がん薬治療、緩和医療(ベストサポーティブケア: BSC)のいずれかを選択し、「抗がん薬適応あり」と判定された場合には、「腫瘍縮小(cytoreduction)」または「病勢制御(disease control)」の2つの治療目標別に、現在利用可能な遺伝子検査による分子サブタイプ分類に基づく薬剤の組み合わせ選択などを推奨している。このような診療アルゴリズムに従うことにより、より広い観点からの患者対応が可能になることが最大のメリットとなる。
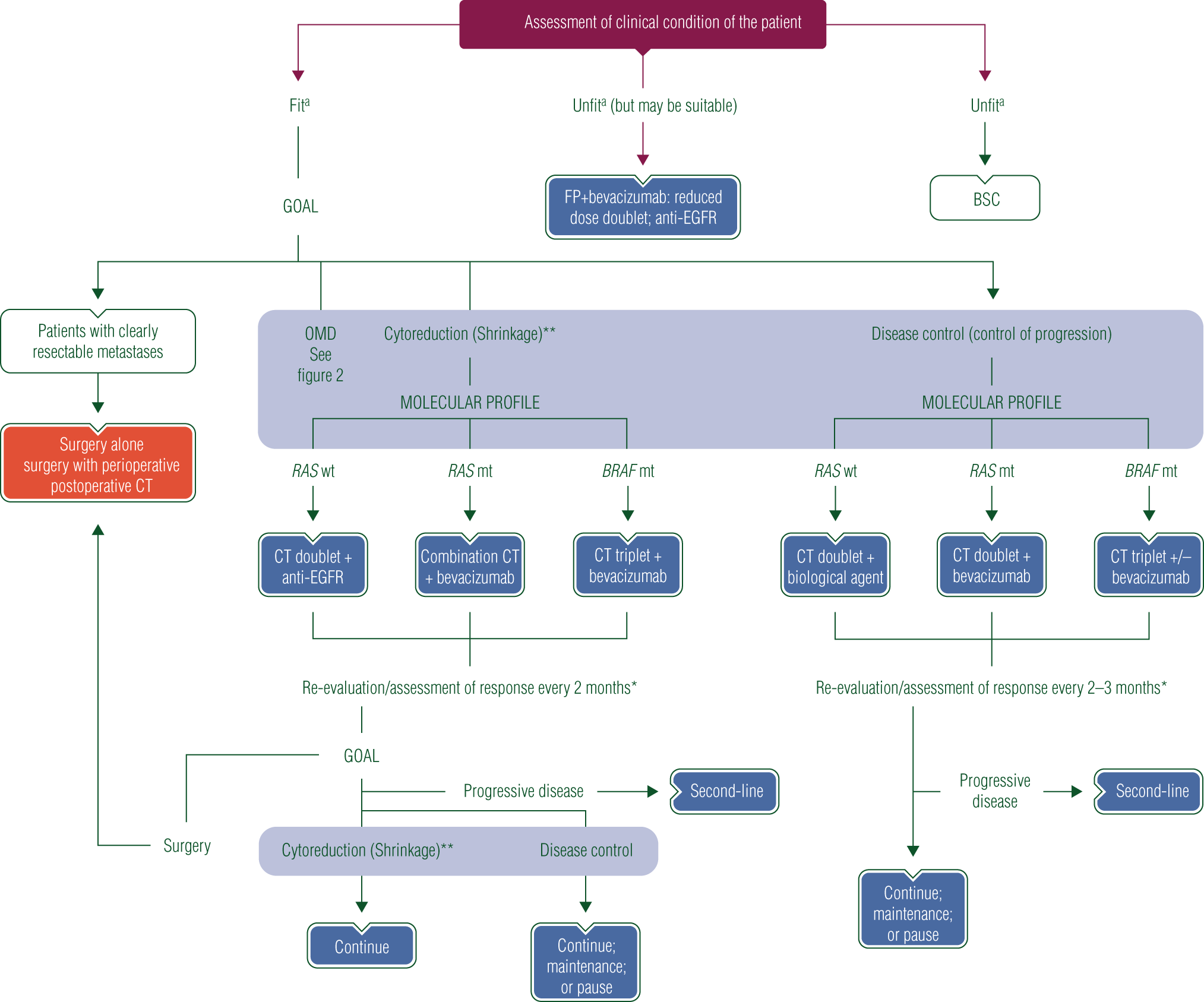
砂川さんは「日常臨床にかなり即した形のものと言え、現場としても使いやすいということで、皆さん参考にされていると思います。日本のガイドラインは米国のガイドライン(NCCNガイドライン)に似ていますが、ESMOガイドラインは、選択肢を一列に並べるのではなくて、抗がん薬に合っている人、さらにその中で2つに分かれているのですが、小さくして切除できる人とか、小さくしなくてはいけない人とか、抗がん薬が必要だけども治すことができない人とか、抗がん薬で予後を延ばそうとする人を分けて、段階的に展開している。
まずゴールを決めて、かつその後に、Ras遺伝子に変異などがあるのかなどを考慮し順送りに追っていけるので、実臨床としては使いやすく、結構使用されていると思います。もちろんこれだけがすべてではないですが、こういう形が臨床としては使いやすい」とその有用性を述べる。
大腸癌研究会では、同研究会編集のガイドライン改訂とは別に、ESMO2016治療ガイドラインのアジア版を現在作成中で、近々(2017年秋)発行することになっており、その中で、経口抗がん薬などアジアに特徴的なものが盛り込まれると見られている。
砂川さんは「大腸がんの抗がん薬治療で、一次治療の期間が一番長い。この一番長い期間をどうするか、といったことをいろいろな施設ごとで先生方がディスカッションしたり、個人的に考えて決めているというのが実態ではないでしょうか。世界的にもそういうところが現状です。その中で、左右差はすでに意識して、左だと抗EGFR抗体を使うという先生方もたくさんいますし、すごく良い情報として日常臨床でも結構使われていると思います。ただ、そういった情報も、左右差だけではなく、他に何か出てくればそれを使って、より目の前の患者さんにとって一番よい、効きそうな薬を選択できるようになってくると思います」と今後の研究の進展に期待を寄せている。
同じカテゴリーの最新記事
- 切除可能な直腸がん試験結果に世界が注目も 日本の標準治療は「手術」で変わりなし
- ビタミンDの驚くべき効果がわかってきた 消化管がん手術後の再発・死亡リスクを大幅に減少
- 世界最大規模の画期的研究の一部解析結果が発表 大腸がんの術後補助療法の必要性をctDNAで判断する
- 初めての前向き試験で抗EGFR抗体薬の信頼性が確実に! 進化を続ける切除不能・進行再発大腸がんの薬物療法
- 遺伝子変異と左右どちら側にがんがあるかが、薬剤選択の鍵を握る! 大腸がん薬物療法最前線
- 化学放射線と全身化学療法を術前に行うTNT療法が話題 進行下部直腸がん 手術しないで完治の可能性も!
- 肛門温存の期待高まる最新手術 下部直腸がんTaTME(経肛門的直腸間膜切除術)とは
- 大腸のAI内視鏡画像診断が進化中! 大腸がん診断がより確実に
- 患者さんによりやさしいロボット手術も登場 新しくなった大腸がんの手術と薬物療法


