早期・探索臨床研究センター(NCC-EPOC):今こそ世界に日本の存在感を示す最後のチャンス 世界のがん専門医療機関トップ10に入れば、ドラッグ・ラグは解消する

日本の患者さんに、より早く新薬が届くようにと、国立がん研究センターは2011年、早期・探索臨床研究センター(NCC-EPOC:エヌシーシーエポック)を立ちあげた。臨床試験のうち、一番最初に行う試験がフェーズ1試験で、これに力を注ごうというわけだ。フェーズ1はなぜ重要なのか。はたしてドラッグ・ラグは解消されるのか。早期・探索臨床研究センター副センター長の藤原康弘さんに話を伺った。
ドラッグ・ラグの原因は?

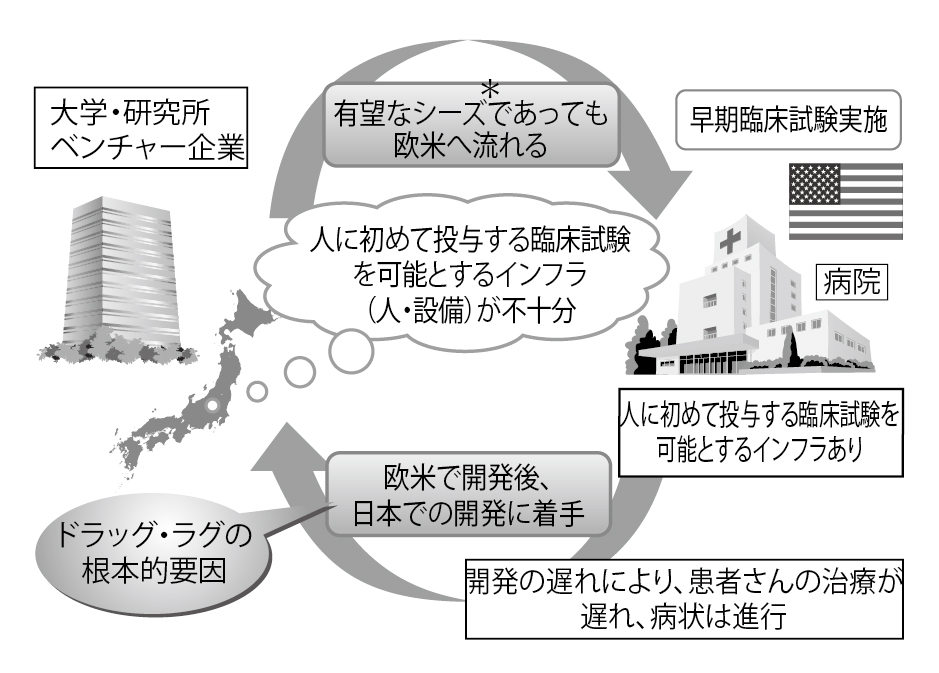
――現在使用されている抗がん薬や分子標的薬は、ほとんど欧米で開発されたものです。また、日本と欧米の間にドラッグ・ラグが存在することも問題になっています。どこに原因があるのですか?(図1)
藤原 日本の国力の低下です。世界から相手にされなくなっているのです。最近の新しいがんの治療薬は、大半が欧米の製薬会社で開発されています。日本の市場は世界の8~10%程度あるので、市場としては悪くありません。しかし、優先順位をつけると、アメリカが第1で、第2はヨーロッパ。日本はその次になるので、市場に導入するのが遅くなってしまいます。これがドラッグ・ラグの原因です(図2)。
――製薬会社の意向でドラッグ・ラグが生じている?
藤原 その通りです。欧米の製薬会社はもちろん、日本の製薬会社だって、まずアメリカで臨床試験を行います。それは、製薬会社が世界の市場を考えたときに、まず欧米で承認を取って市場に出さないことには、自分たちが生きていけないからです。グローバルな競争社会で生き抜いていくためには、日本市場だけを見ているわけにはいきません。
――海外の企業にとって、日本は特殊だということはあるのでしょうか。
藤原 そういう問題もあります。言葉の壁がありますし、文化的に新しいものは最高のものと思いがちな傾向もあります。また承認された薬は100%安全であると考え、リスクは絶対ゼロでないことを受け入れないという思いも強いです。そういう社会に新しい薬を持っていくことに、企業、とくに世界で競争している企業には抵抗感はあると思います。やはりアメリカやヨーロッパで発売して、それから日本に持ってきたほうがよさそうだと考えるでしょうね。
質の高い日本の臨床試験
――そうすると、ドラッグ・ラグが生じるのは、日本で治験がうまく進まないことが原因ではないのですか。
藤原 抗がん薬に限って言えば全く違います。治験は問題なく行われています。海外に比べても、日本の医療環境はいいですし、実際に非常に質の高い治験が行われています。
――人数がそろわないとか、患者さんへの説明がうまくいかないといった問題は?
藤原 少なくとも今はないですね。医師の側も、いい薬の候補と思えば、どんどん治験を行うようになっています。そのような場合、いったん治験が始まると、日本くらいスピードが早くて、患者さんの同意をしっかり取っている国は、実はあまりないのです。
――厚労省が承認するまでの審査に、時間がかかるといった問題はどうでしょう?
藤原 かつてはそうだったかもしれませんが、現在はそんなことはありません。巷でいわれているほど、治験のスピードや審査のスピードは、ドラッグ・ラグの原因にはなっていません。要するに、開発中の薬の治験実施の依頼が、日本にこないだけの話で、日本で開発がスタートしたり、審査を受けるための申請をする時期が欧米に比べて遅いのです。ただ、例えばアメリカの企業が自国で承認をとって、その後に日本で開発しようとします。それを日本の政府がいくら早く日本でも開発しろといっても、米国企業にはそれぞれ戦略があるので、必ずしもうまくいくわけではありません。そこは難しいところだと思います。
変わってきたフェーズ1試験
――フェーズ3試験はどの群に振り分けられるかわからず、新薬の効果が得られるとは限らないため、患者さんの参加意識が乏しいと聞きますが。
藤原 フェーズ3試験は、どちらの群に入っても損をしないという科学的前提がないと、試験を始められません。新薬がいいかどうかは、試験をやってみないとわからないわけです。そこを冷静に患者さんに説明するようにしています。新薬の群に入るほうが、利益が大きいと考えているのは完全なる誤解です。
――フェーズ1試験に対する心理的な壁は大きいと思いますが、参加するのはどのくらいの割合ですか。
藤原 アメリカだと参加するのが5%程度。日本でもだいたいこのくらいだと思います。
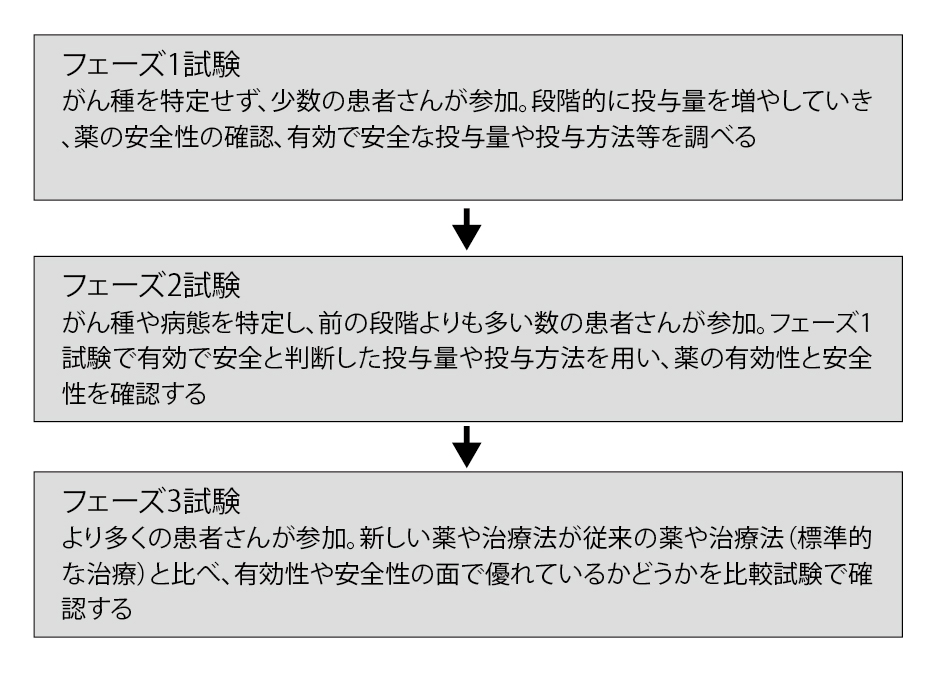
――フェーズ1試験は「薬を人に投与してどの量まで耐えられるか」という最大耐量を決める試験で、少人数で決めていますが、そこに問題はないのですか(図3)。
藤原 かつての抗がん薬のフェーズ1試験は、最大耐量を決定するのが重要な仕事でした。しかし分子標的薬や抗体医薬の時代になって、毒性が出ない薬も結構あります。そのため、現在のフェーズ1試験は、生物学的な適正量を求めることが主眼になっています。また最近では「ベイズ理論」という確率論の考え方を取り入れ、副作用の出方に関して少人数の患者さんでなるべく正確な結果が出せるような新しい方法による治験・臨床試験も行われています。薬の開発に関して、無限に予算と時間があるわけではありません。得られたデータをもとに、いかに低予算でかつ短期間で薬を患者さんに届けるか、企業は努力しているのです。
重要な役割を果たすCRC
――薬の効果を判定する場合、最近は生存期間が重視されていますが、患者さんにはどのように説明するのですか。
藤原 全生存期間で評価するというのは、あくまでもFDA*の見解であって、患者さんにとっての効果というのは人それぞれです。例えば、腫瘍が少し小さくなるだけで、おなかの張りがよくなったとか、食べられるようになって元気が出たとか、そういったことも患者さんには重要です。ですので、薬の効果についてはさまざまな観点から患者さんには説明しています。もちろん、医薬品を承認する規制当局にとっては、「全生存期間」といった判断を下すための客観的な指標が必要です。ただ、それは患者さんが「効果があった」と感じるのとは別の次元の話になります。
――治験・臨床試験ではCRC*が重要な存在なのですね。
藤原 CRCは、臨床研究をサポートするコメディカルです。診療の中で看護師や薬剤師、臨床検査技師の方たちが果たしている役割を、治験・臨床試験の中で担っています。患者さんにしてみると、医者にはものを言いにくいけれど、CRCになら言いやすい、という存在でしょう。私たち医師からすると、医師とはちょっと違う視点から患者さんの声に耳を傾け、伝えてくれるのでとても助かります。
*FDA=米国食品医薬品局 *CRC=臨床研究コーディネーター



