臨床試験ガイド❶
治験を受けられるのは〝代表選手〟 意義、メリット、デメリットを理解して参加

宋 菜緒子さん
臨床試験や治験というと、言葉は知ってもいても、どのように行われているのかよく知らない、自分とは縁遠いものだ、と思っている患者や家族も多い。近年は免疫チェックポイント阻害薬に代表される新薬の研究が相次いでおり、医療機関に持ち込まれる治験の数も増えている。2回にわたり、臨床試験、とくに新薬を対象とした治験について分かりやすく解説する。
新薬ができるまで
新薬が市場に出回るまでには、いくつかの段階を経る必要がある。その中で避けることができないのが、人を対象に行う臨床試験だ。
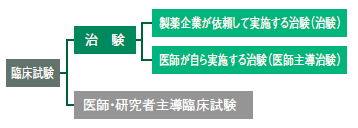
臨床試験の中でも、治験とは、日本ではまだ保険医療として使用されていない治療薬について、医師や製造元の製薬企業が主体となり厚生労働省の承認を得るために安全性と有効性を確かめるもので、とくに「治験」と呼ばれる。
治験以外の臨床試験は、治療法を確立するために医師らが主体的に行う研究で、研究者主導臨床試験といわれる。対象は、手術・化学療法・放射線療法を組み合わせた治療や、複数の抗がん薬を組み合わせた治療、免疫療法、緩和ケアなどとなる。
臨床試験とはどういうものなのか、まず薬剤開発においてどのような位置付けなのか見てみよう。
1)基礎研究
製薬企業や研究機関では、天然素材(植物・動物・鉱物など)からの抽出や、化学合成、あるいはバイオテクノロジーなど様々な科学技術を用いて、薬の候補となる化合物を造る。最近はゲノム情報の活用も注目されている。
2)非臨床試験
薬になる可能性のある新規物質の有効性と安全性を、動物を用いて確かめる。物質が体の中でどのように吸収されて、どのような影響を与え、そして体の外へ排泄されていくのかなどが観察される。
3)臨床試験(治験)
非臨床試験を通過した薬の候補が、人にとって有効で安全なものかどうかを調べる。治験は段階的に行われ、「医薬品の臨床試験の実施の基準に関する省令」に定められた要件を満たす病院などの医療機関で行われる。薬としての世に出せるものかどうかを判断する。
4)承認申請と審査
臨床試験でのデータから、薬として有効性・安全性・品質が証明された後、製薬企業は厚生労働省に対して承認を得るための申請を行う。厚労省では、医薬品医療機器総合機構(PMDA)に審査を依頼し、その審査を通過した後に、学識経験者などで構成する薬事・食品衛生審議会の審議を経て、厚生労働大臣が許可すると保険適用の医薬品として製造・販売することができるようになる。
臨床試験とは
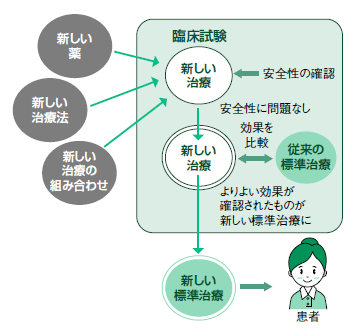
前項では新薬を例にしたが、新薬だけではなく手術、放射線治療などを用いた新しい治療法、あるいはそれらを組み合わせる治療法、既存薬の他の疾患への適応などに対して、その効果や安全性について確認するために行われる試験のことを臨床試験という(図1)。
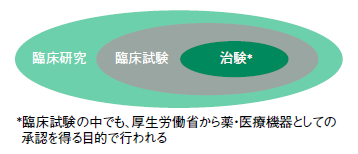
似た用語があるので、整理しよう。まず、臨床現場で人を対象に行われる研究すべてを「臨床研究」という。その中で、評価したい薬や治療法などを人に投与したり施術したりする研究を臨床試験という。
さらに、臨床試験の中でも、製薬企業などが厚生労働省から薬や医療機器としての承認を得ることを目的として行うものを「治験」という(図2)。治験は臨床試験の一種というわけだ。製薬企業が病院など医療機関に協力を求める形で行われる。近年は医師の立案・計画に基づく「医師主導の治験」という制度もできた(図3)。
治験の段階(ステージ)
ここからは実数の多い治験を対象に述べる。治験は3段階に分かれている。がん治療を想定し、一般的な例を示す(表4)。

第Ⅰ(I)相(フェーズⅠ(I)):参加人数15~30人。がん種を絞らずに、副作用などの安全性について確認する。投与方法、投与間隔、適切な(至適)用量、他薬との組み合わせなどが調べられる。
第Ⅱ(II)相(フェーズⅡ(II)):同100人未満。第Ⅰ(I)相試験で得た用量などのデータを元に、がん種を絞って有効性を確認する。
第Ⅲ(III)相(フェーズⅢ(III)):同100~数千人。治験薬と標準治療を比較する。新薬が標準治療よりも優れているか同等(非劣性)ならば、承認の条件を満たす。
第Ⅳ(IV)相(フェーズⅣ(IV)):同数百人~数万人。新薬や新治療法の長期間にわたる効果と副作用の追跡調査。承認され市販されたあとに実施されるため、市販後臨床試験とも呼ばれている。
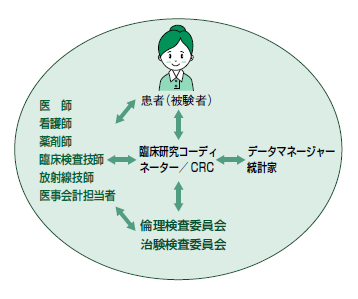
治験コーディネーターの役割
治験には、患者(被験者)、医師、製薬企業などがそれぞれの立場で関係する(図5)。その連絡役となり、治験の円滑な運営をサポートする専門スタッフを治験コーディネーター(Clinical Research Coordinator: CRC)という。看護師や薬剤師など、看護や薬剤の知識をもつことが多い。
その1人、がん研有明病院の臨床研究コーディネーターで、看護師である宋菜緒子さんは、「患者さんとは、薬の服用のサポート、副作用の自己管理、あるいは全体的な相談などの面で接しています。一方で、医師に対しては実施計画書に則った運用や診療のサポートをする。そして製薬会社に対しては、しっかりしたデータを取って承認申請のサポートをする役割があります」と仕事の内容を解説する。
患者には治験に入る時から関わる。患者にとっては、新薬の未知なる副作用への不安が一番大きい。その心理面をサポートしながら、かつ正確なデータを上げるためには、内服時間など生活の規制も守ってもらわなければならない。このため患者との間に「濃密な関係」を持つ必要性が出てくるという。
第Ⅰ(I)相試験
宋さんに、各フェーズ相の試験について、現場の実態を踏まえて詳しく聞いた。
「第Ⅰ(I)相試験の対象はほとんどが標準治療を終えた患者さんです。毒性を見ることが主な目的で、治療的要素は少ない。試験のデザインにもよるが、用量を少しずつ変えて服用や点滴してもらい、用量規制毒性が出た群の一段階下が推奨用量として第Ⅱ(II)相に上がります」
宋さんは第Ⅰ(I)相試験の現場の様子を次のように話す。
「段階的に毒性を見るので成分がほとんどないものを投薬されるグループもあります。薬物がどう吸収されて、代謝され、排出されるのかを見るため、頻回な採血など、どうしても実験台という感じになってしまいます。それを納得した上で治験に入ってもらうために、患者さんへの説明はより丁寧にしています」
それでも、希望する患者は多いという。
「第Ⅰ(I)相試験の位置付けを理解した上で、それでも一縷の望みをかけて新しい薬にチャレンジしてみたいという方が多いですね。無治療や苦痛を和らげる対症療法を選択するのが普通の流れという中で、実験的、研究的な治験もあることを知ると、何かにトライしてみたいということで積極的に参加してくれる患者さんもたくさんいます」
第Ⅱ(II)相試験
安全な量が判明したら、次は安全性とともに有効性を調べる。第Ⅰ(I)相のデータで得た推奨用量に合わせて、特定のがん種に対して効果があるかどうかを調べる。
「第Ⅱ(II)相では有効性を見なければならないので、被験者のバックグラウンドをそろえなければいけません。病期や治療歴などです。第Ⅱ(II)相からは治療的要素もありますが、もちろん、効くかどうかはわかりません。予測できない副作用もあり得ます。もし、この段階で治験薬に有効性が見られなければ、第Ⅲ(III)相に上がりません。途中で終わって行く試験も多くあります」
希少がんや治療の選択肢が少ないがんなどの場合、第Ⅱ(II)相で有効性と安全性が確認できれば第Ⅲ(III)相試験を省略して承認申請されることもある。
第Ⅲ(III)相試験
新しい治療法と標準治療の比較を、ランダム化比較試験(Randomized Controlled Trial: RCT)で行う。被験者を無作為に①新しい治療法を受けるグループ(試験治療群)、②標準治療を受けるグループ(対照群)に割り付け、それぞれの薬の効果を測定・評価する。
治験薬が上乗せ効果を期待される薬である場合は、試験治療群は標準治療+治験薬、対照群が標準治療+プラセボ(偽薬)、といった形になる。被験者は自分が試験治療群に入ったのか、対照群に入ったのかがわかる場合もあるが、試験によっては二重盲検法で行われ、この場合は医師も被験者も誰がどちらの群に入ったのかわからない。