バイオバンクの現状 日本の医学研究・新薬開発を支援するバイオバンク
遺伝子変異検査や分子標的薬の治療効果判定などにも活用が可能に

手術や検査で採取された組織(腫瘍など)や血液など、診断に使われた後の試料を患者さんの同意を得た上で収集・保存し、医学研究や新薬開発に役立てるために分配(以下:分譲)する施設を「バイオバンク」と呼ぶが、国内外でその設置が進んでいる。そこで、バイオバンクが実際にどのように運営されているのかを中心に、筑波大学附属病院つくばヒト組織バイオセンターの竹内朋代さんに聞いた。
生きた組織に近い状態で保存
大学病院は医療施設であると共に、医学研究機関でもある。そこで手術や検査のために採取された組織や血液、尿などの検体は、診断が済んだ後も医学研究に使用されている。
例えば肺がんでは、組織の遺伝子変化などを解析することで新しい治療法のヒントが得られ、実際に現在、治療薬として使われているものもある。
しかし、それらの検討を行うには、組織が生きていた状態に近いことが条件になる。学校の理科室にあるようなホルマリン漬けの標本では、様々な物質や遺伝子さえも破壊されてしまう可能性が高い。そこでバイオバンクでは、-196℃という低温で瞬間的に凍結できる液体窒素を使って組織等の試料を凍結した後、-80℃の冷凍庫で保存している。
2013年11月に本格的に稼働
つくばヒト組織バイオセンターは昨年(2013年)11月に本稼働を開始したばかりのバイオバンクである(部長:消化器外科・大河内信弘教授、副部長:診断病理研究室・野口雅之教授)。
同センターは医学部との兼務である竹内さんと専任看護師1名、臨床検査技師2名で運営されており、主にデータ管理を行う3階の1室と、実際に組織の処理・保存容器への封入、冷凍保存を行っている地下の1室、計2室から成る。各部屋への出入りは静脈認証システムやパスワード入力、暗号錠などで厳重に制限されている。
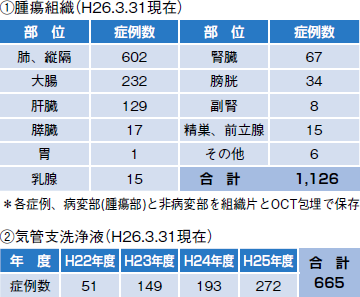
今年3月末時点の保存試料は腫瘍組織関係だけで1,126人分だが、実際は1人から数検体が採られることが多いので、検体数としてはこの10倍くらいになる(表1)。
入口の静脈認証システム

バイオバンク設立の予算がつく
まず、竹内さんにバイオセンター発足の経緯について伺った。「筑波大学に限らず、大学病院ではこれまで研究グループ毎に組織検体の保存をしていました。例えば呼吸器科であれば呼吸器のサンプルだけ、消化器科は胃や腸のサンプルだけを集めていたわけです。
このやり方だと、自科のサンプルしか研究に使えないこと、また検体の管理者が他施設に移動したりすると、何がどこにあるのかわからなくなることが多かったのです。問題の解決には集中管理がよいことはわかっていたのですが、資金や人手の問題もあってなかなか手を付けられませんでした。
それが2009年に筑波大学人間総合科学研究科の事業として、2年間の予算が付いてバイオバンクを作ることになりましたが、途中で予算が切れたため、病院の附属施設となりました。そこから昨年11月のオープンまでの合計4年間は基盤整備に費やされました」
外部への試料分譲の説得に多くの時間を要する
このバイオバンクセンターの特徴の1つは外部への試料分譲をしている点だが(4月22日時点で申請が4件あるが実績はまだない)、これを関係者に受け入れてもらうのに非常に時間が掛かったという。
「日本のバイオバンクで最大の問題点は、試料を分譲している施設が少ないことです。収集は関連病院があれば可能ですが、それを外部の研究者が使えるようになっていません。筑波大でも全く同じ問題があり、患者さんは研究用に自分の組織を使ってもらうことには比較的抵抗がないのですが、大学関係者は附属病院で収集した組織を外部に出すことに難色を示す方が多く、説得に4年も要してしまいました。しかし、外部に試料を分譲するというのは非常に重要なことなのです。
現在、日本の研究者は国内で組織試料が手に入りにくいために、海外から購入することが多いのですが、人種によって様々な違いがありますし、遺伝子も若干異なります。それから、海外で販売されている組織は臨床情報が大ざっぱです。肺がん男性くらいしか情報が付いていません。新薬を開発するとか、治療法を見つけるための研究の場合、臨床情報が少ないと研究になりません。ですから、当センターでは、できるだけ詳しい臨床情報を付けて試料をお出ししたいと思っています」
日本で外部への試料分譲を行っているのは、神奈川県立がんセンター臨床研究所、大阪の医薬基盤研究所くらいだそうである。



