新規薬剤の登場と明確にすべき課題
総合的な対応が必要に HR陽性、HER2陰性・進行再発乳がん

乳がんを分子生物学的に分析し、どの薬剤が効果が高いのかを判断するためにサブタイプとして分類することが一般的な治療として広がり、それぞれの患者さんに適した治療選択が行われている。その中で、「閉経後進行再発乳がんのホルモン受容体陽性・HER2受容体陰性タイプ」について最新情報をリポートする。
ホルモン陽性にはアロマターゼ阻害薬が基本
再発パターンの経時的変化
平均余命が伸びる中、閉経後の乳がん治療が課題となっている。ホルモン陽性・HER2陰性の乳がんは、日本人女性の乳がんの全体の約7割を占める。
例えば、40歳代で早期乳がんと診断され治療を受けても、再発症例を入れると、治療の対象となる患者は80歳代以上までカバーする必要がある。
「乳がんはおおよそ90%が手術可能な早期で見つかりますが、手術しても、進行・再発する割合は30%ほどにも上ります。とくにホルモン陽性乳がんでは、ずっと再発リスクを抱えていることになり、患者さんにとってはとてもストレスがかかります。
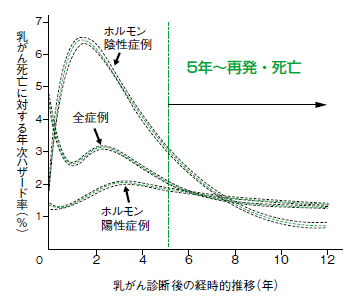
一方で、ホルモン薬や分子標的薬が効きにくいとされる、ホルモン(エストロゲン、プロゲステロン)陰性・HER2陰性のトリプルネガティブ乳がんは、手術直後には再発リスクが高いものの、5年ほど経つとほぼ再発しないといわれております(図1)。
また、長期間経過しても再発するのがホルモン陽性乳がんの特徴なので、前治療期間と再発までの時間軸をしっかりと意識した治療選択が必要となります」とがん研有明病院乳腺センター乳腺内科医長の荒木和浩さんは、このように説明する。
ホルモン陽性乳がんというのは、女性ホルモンであるエストロゲンががん細胞の核に存在するエストロゲン受容体に結合し、がん細胞を増殖・転移・血管新生させることが特徴。
治療法としては、女性ホルモンに働きかけるいわゆるホルモン療法が取られ、エストロゲンをエストロゲン受容体に結合させないように、同受容体をふさぐ*タモキシフェンなどの抗エストロゲン薬、あるいは、閉経後の女性でも副腎で分泌される男性ホルモンであるアンドロゲンが脂肪組織のアロマターゼと呼ばれる酵素でエストロゲンに変換されることを妨げる*フェマーラや*アリミデックスなどのアロマターゼ阻害薬が使われている。
*タモキシフェン=商品名ノルバデックスなど *フェマーラ=一般名レトロゾール *アリミデックス=一般名アナストロゾール
ホルモン薬耐性の仕組み
「ホルモン陽性乳がんの治療の中心はホルモン療法となります。閉経後の再発ケースで重要なのは、ホルモン感受性が残っているのかどうかです。現時点の手法では、前治療がどれくらい効いていたかを時間軸で判断します。ホルモン薬を数カ月という短期間で替えている場合は、ホルモン療法が効きにくくなっていることが考えられます」(図2)
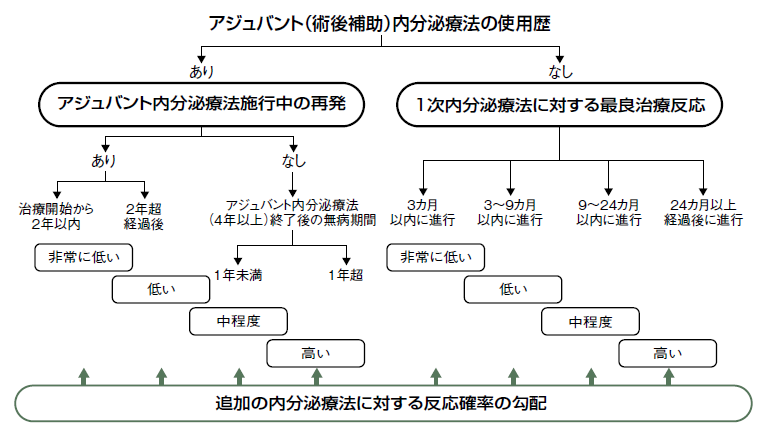
ホルモン療法が効いていれば長く続けてもいい。しかし、効かなくなった場合は抗がん薬での治療となる。
ホルモン療法が効きやすい場合は再発しにくいし、再発しても違う薬を使えば効果が期待できる。しかし、状況は変わってきた。
「今までは前治療のホルモン療法の経過が長ければ、次の薬に切り替えても効きやすいと考えていましたが、そこに分子生物学的な手法が入ってきて、1人ひとりが同じ経過をたどらないとわかってきました。ホルモン陽性の中にもいろいろなタイプがあり、組織型が同じでも予後が異なります」
分子標的薬を治療選択に加える時代となった。ホルモン療法に耐性が出た患者さんを同薬で救えないかということだ。ホルモン薬と分子標的薬を併用したほうがいいという戦略が取られている。
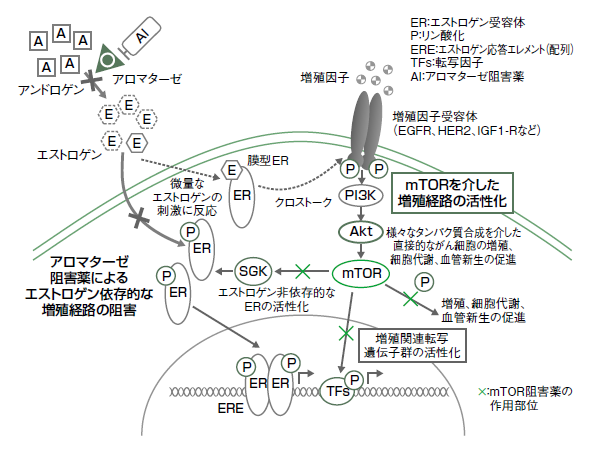
薬剤耐性が起きる仕組みは、ホルモン療法薬ががん細胞の核にある受容体にエストロゲンが結合しないようにブロックすると、がん細胞では別ルートとして細胞の表面にある種々の増殖因子受容体を経由したり、その他の迂回路を通ってエストロゲンに依存しない、がん細胞の増殖につながってしまうのだ。
分子標的薬が治療選択に
ホルモン療法の耐性を克服しようと登場したのが、分子標的薬ということになる。
「乳がんの進行のスピードが速い患者さんは、ホルモン薬より従来の抗がん薬のほうが効果的ですが、スピードがそれほど速くなく、抗がん薬を使うほどでもない方にチャンスが出てきています」
1つは、*アフィニトール。2014年に日本で手術不能または再発乳がんに対して承認された。
作用機序は細胞内にあるmTOR(哺乳類ラパマイシン標的タンパク質)という細胞内のタンパクに作用して、ここでがん増殖のシグナルをブロックする。乳がんの悪化に関わるシグナルの迂回を許さないという薬だ(図3)。
(ホルモン受容体と増殖因子受容体のクロストーク)
国際共同試験「BOLERO-2」の結果、アフィニトールをホルモン薬である*アロマシンと併用したところ、無増悪生存期間(PFS)がホルモン療法単独群で2.8カ月だったのに対し、アフィニトール併用群では6.9カ月と大きく延長した。一番のキーとなるところを叩くという考え方だ。しかし、状況はそれほど単純ではないという。
「シグナル伝達の下流を抑えれば、がん細胞が増殖しないだろうとされたのですが、がん細胞も学習効果があるので、ほかの経路(迂回路)を見つけます。細胞内の経路は複雑に絡み合っていて、違う経路が活性化することもあります。残念ながら、現在の医療ではまだすべてを解明できていません」
*アフィニトール=一般名エベロリムス *アロマシン=一般名エキセメスタン
相次ぐ新薬の報告
模索が続く医学界だが、今年の米国臨床腫瘍学会学術集会(ASCO2015)で、新しい報告があった。
ホルモン療法後に増悪した、ホルモン陽性・HER2陰性の進行乳がん女性に対する治療として、閉経後乳がんホルモン治療薬である*フェソロデックスにCDK4/6阻害薬である*Ibrance(イブランス)を併用した場合と、Ibranceにプラセボ(偽薬)を加えた治療を比較した多施設共同二重盲検第Ⅲ(III)相試験「PALOMA-3」において、無増悪生存期間がIbrance併用群では9.2カ月で、プラセボ群3.8カ月と、新薬のほうに有意な延長が認められたのだ。
Ibranceは別の無作為化第Ⅱ(II)相試験結果に基づいて15年2月に、米国食品医薬品局(FDA)から「ホルモン陽性・HER2陰性閉経後進行乳がん」に対し、アロマターゼ阻害薬であるフェマーラとの併用による1次治療薬として適応承認を受けている。
「選択肢が増えたことは、治療には大きな進展です。フェソロデックスとの併用は無増悪生存期間を延長させたということで、高く評価できます。これより先にフェマーラとの併用がFDAに迅速承認されています」と荒木さんは言う。
さらに、2012年のサンアントニオ乳がんシンポジウム(SABCS2012)では、フェソロデックス高用量500mgと標準とされていた250mgの治療効果を比較したCONFIRM試験の最終解析が報告されている。
それによると、フェソロデックス高用量投与により、全生存期間(OS)の延長と死亡リスクを低下させることが判明した。日本でも、フェソロデックス500mgの使用が広まっている。
「現時点では500mgの使用は日本だけではなく海外でも標準治療になっています。日本でも保険適用です」
*フェソロデックス=一般名フルベストラント *Ibrance(イブランス)=一般名palbociclib(パルボシクリブ)
治療マネジメントが一番大事
荒木さんは、この領域の治療の難しさを指摘する。
「様々な薬剤が開発され、選択肢は広がっているのですが、現時点では、ホルモン療法耐性に対するキーファクターとなるものがはっきりしていないので、耐性細胞のどこに異常があって、どの阻害薬をどういう順番で使ったらいいのかは、まだ分かっていません」
荒木さんが強調するのは、患者さんの転移の状況と、副作用、そして医療経済的な問題、医療機関の体制などを総合的に考えることだ。
「新しい薬が出ると、早速使おうとなるかもしれません。期待はあるのですが、個々で考えなければいけないのが、転移、副作用と医療費です。また、ただ処方すればいいわけではないので、医療機関としてのマネジメントも重要です。医師により新薬導入に対する温度差もあります。どこに転移していて、その大きさはどうなのかという問題、副作用、そしてコストを含めて全体で考えていかなければなりません」
マネジメントは医師だけでは不十分で、看護師や薬剤師などのチームを作って、情報共有を進め副作用対策だけではなく、患者さんの意見を汲み取る治療体制を作るという意味だ。
「例えば、主治医が出張に出かけている時でも大丈夫なように体制を作っておくべきです。みんなで作っていくべきです」
これからも研究や新薬開発を進めなければならない分野だけに、信頼できる医師と出会うことも大きなポイントとなる。
同じカテゴリーの最新記事
- ホルモン療法中は骨折リスクに注意! アロマターゼ阻害薬服用時の骨粗鬆症治療
- より推奨の治療法が明確化した「ガイドライン」 HR陽性、HER2陰性の進行・再発乳がんの最新治療
- がん治療中も後も、骨の健康が長生きの秘訣 ホルモン療法に合併する骨粗鬆症を軽視しない!
- 新薬続出で選択肢が広がった去勢抵抗性前立腺がん(CRPC) 「どの薬をどのタイミングで使うか」が見えてきた!
- ホルモン陽性・HER2陰性進行再発乳がんに新薬が今年中に承認予定!
- センチネルリンパ節転移陽性乳がんへの新しい治療対応
- 新薬登場でここまで変わった! 去勢抵抗性前立腺がん薬物療法の治療戦略
- ホルモン療法の副作用対策 抗がん薬とは異なる副作用が発現
- 去勢抵抗性前立腺がんの治療選択 個別化・適正化で患者の利益が求められる



