バイオシミラーとジェネリック医薬品との違い バイオ後続品“バイオシミラー”の開発状況と今後の展望

バイオシミラーとは、バイオ医薬品の後続品である。化学合成品の医薬品であれば、それと同一の物質が合成され、ジェネリック医薬品(後発医薬品)として広く使用されている。ところが、バイオ医薬品の後続品は、開発が技術的に難しく、臨床試験が必要になるなど審査も厳しい。しかし、がん治療で使われているバイオ医薬品が特許切れの時期を迎えたこともあり、バイオシミラーの開発が活発になっている。ジェネリック医薬品との違いや、今後の展望について解説していただいた。
バイオ医薬品にも後発品がある
近年、新薬の開発が進められている一方で、ジェネリック医薬品(後発医薬品)が広く使われるようになっている。がん医療の分野でも、それは全く変わらない。
国立がん研究センター中央病院薬剤部長の山口正和さんは次のように話している。
「最近はジェネリック医薬品の抗がん薬が、ごく当たり前に使われています。当院でもそうですし、どこの病院でもそうだろうと思います。その理由として、ジェネリック医薬品の品質が良くなっていることや、流通がしっかりしてきたことが挙げられます。さらに患者さんの医療費を抑えられるのであれば、ということで積極的に使用しています」
ジェネリック医薬品は、新薬と同じ有効成分を含んでいる医薬品である。医薬品が特許を取ると、一定期間は特許を持つ企業のみが、その医薬品を製造販売することができる。しかし、特許が切れた場合には、他の製薬企業も同じ有効成分の医薬品を製造販売できるようになる。これがジェネリック医薬品である。
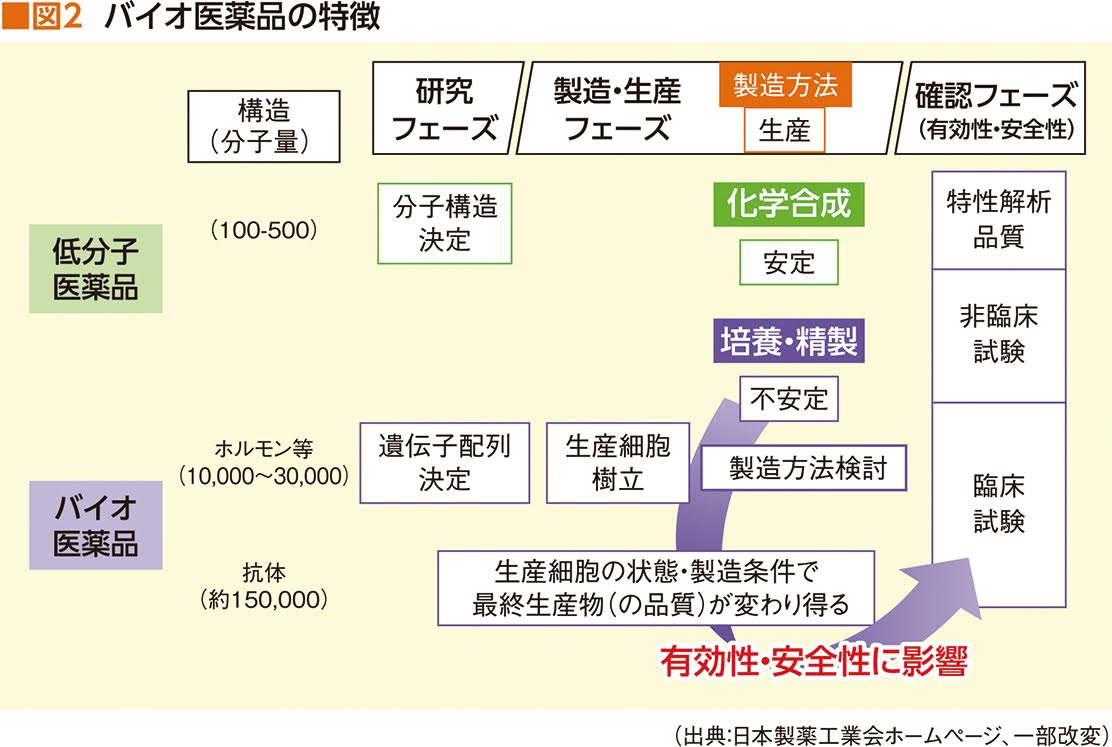
近年、注目を集めているのが、バイオ医薬品の後続品といえるバイオシミラーである。数年前から、がん領域でもいくつかのバイオ医薬品が特許切れの時期を迎えており、その後続品の開発が進められていた。バイオ医薬品の後続品が、他のジェネリック医薬品と区別して、バイオシミラーと呼ばれるのには、それなりの理由がある(表1)。

「通常の医薬品は化学合成品ですから、分子量が小さく、先行医薬品と同じ物を作ることができます。ところが、バイオ医薬品はタンパク質ですから、分子量がとても大きくなることもあって、全く同じ物質を作れるかというと、それはできないのです。もちろん、バイオ医薬品のアミノ酸配列や構造は明らかにされていて、それと同じタンパク質はできるのですが、微妙なところで同じ物質にはならないわけです」(山口さん)
バイオシミラーの「シミラー」には「類似した」といった意味がある。先行医薬品と全く同一の物質ではないため、バイオ後続医薬品はこう呼ばれているのである。
どうして同一の物質にならないのか、国立がん研究センター中央病院薬剤部主任の西垣玲奈さんは、わかりやすく次のように説明してくれた。
「低分子化合物の医薬品は、化学合成で作り出されます。それに対し、バイオ医薬品は、動物の細胞や細菌などを利用してタンパク質を作らせます。生き物が作り出すのですが、その方法が特許になっているので、後続品を開発するためには、別の生き物を使って、同じ構造を持つタンパク質を作り出さなければなりません。非常に難しいわけです。こうして有効成分であるタンパク質は同じ構造のものを作り出せても、不純物の入り方などが微妙に違ってしまいます。こうして生み出されるバイオ医薬品の後続品がバイオシミラーなのです」
全く同一の物質ではないが、医薬品に含まれる有効成分は同じ。だからこそ、先発品と同様の効果が期待できるのである(図2)。
新薬に近い審査が行われる
ジェネリック医薬品もバイオシミラーも、医薬品として使用できるようになるためには、PMDA(医薬品医療機器総合機構)に申請して承認を得なければならない。承認までに、どのような審査が行われるのだろうか。
「化学合成品のジェネリック医薬品の場合、ポイントとなるのは同等性です。作り方が特許になっているわけですが、分子量が小さい低分子化合物であれば、同じ物質を作ることは、さほど困難ではありません。その物質が、先発品の有効成分と化学的に同一の物質で、それを投与したときの血中濃度など、体内動態が同じであることを証明する必要があります。それができれば、臨床試験などを行う必要はありません」(山口さん)
ジェネリック医薬品はこのようにして承認されるが、バイオシミラーが承認に至る過程は、これよりもはるかに困難である。
「有効成分はタンパク質なので、そのタンパク質とアミノ酸配列が同一のタンパク質が含まれていることを証明する必要があります。これが大前提となります。次に不純物などを調べ、わずかな違いがあっても安全性や有効性に影響しないことを証明する必要があります。さらに、有効成分のタンパク質がきちんと働くのかどうかを調べます。例えば、受容体との結合活性を調べたりするわけです。こうした試験に加え、バイオシミラーの承認には臨床試験が必要になります。ここがジェネリック医薬品と大きく異なる点です。臨床試験を実施し、先発品のバイオ医薬品と臨床的に同等であることを証明しなければなりません。まさに、新薬の承認に近いレベルの試験が必要とされているのです」(西垣さん)
バイオシミラーの開発は、ジェネリック医薬品の開発に比べ、かなりハードルが高いといえそうだ。高い技術力が必要だし、開発に必要となる金額もはるかに大きくなる。そのため、この分野に参入してくるのは、技術力と資金力を有する製薬企業ということになる。



