ゲノム医療がこれからのがん治療の扉を開く 遺伝子検査はがん治療をどう変えるか

がん患者のゲノム(遺伝子情報など)を調べて、がん細胞の遺伝子変異を検出し、それに見合ったより効果の高い治療法を選ぶ「ゲノム治療」。厚生労働省は、がん医療を充実させるための重点施策として取組みを加速させている。
このゲノム医療のベースになるのが「遺伝子検査」だ。近年、先進医療として実地応用が進んでいる。このように遺伝子検査、ゲノム医療はこれからのがん医療をどう変えていくのか。国立がん研究センター先端医療開発センタートランスレーショナルインフォマティクス分野長の土原一哉さんに聞いた。
がん遺伝子検査には2タイプある
我々の身体は膨大な数の細胞の集まりでできている。そして細胞の核の中にはDNAがあり、そこに刻み込まれた生命に関する情報がゲノム。生命の設計図とも呼ばれるこのゲノムに散在している遺伝子の配列を調べるのが「遺伝子検査」だ。
がん診療で行われる遺伝子検査には2つのタイプがある。1つは、生まれつき持っている遺伝子の配列を調べるもので、遺伝性の高いがん(遺伝性腫瘍、家族性腫瘍)の発症リスクの判定に利用される。遺伝性の高いがんとしては、遺伝性乳がん・卵巣がん、リンチ症候群(遺伝性非ポリポーシス大腸がん)、家族性大腸ポリポーシスなどが知られている。たとえば、遺伝性乳がん・卵巣がんの場合、BRCA1、BRCA2とういう遺伝子に変異があると、がんにかかりやすくなる。
「こうした遺伝性の高いがんになりやすい人の持つ遺伝子変異は、親から子へと50%の確率で受け継がれます。それだけに、家系的にリスクがあると考えられる方が、遺伝子検査により異常を早く見出すことは、がんの早期発見につなげたり、予防対策を講じる上で大きな意味がある」と国立がん研究センター先端医療開発センタートランスレーショナルインフォマティックス分野長の土原一哉さん。
もう1つは、がん細胞でのみ生じている遺伝子変異をチェックする検査(体細胞変異検査)。手術や生検で採取したがん患者のサンプル(がん細胞)を情報源として、どの遺伝子に異常があるかを調べる。ゲノム医療との関連で、いま話題となっているのは、こちらのほうだ。
分子標的薬の選択には遺伝子検査が欠かせない
土原さんによると、このタイプのがん遺伝子検査が注目されるようになったのは、分子標的薬の登場がきっかけだったという。
「がんが遺伝子の突然変異によって起こることは、以前からわかっており、がん細胞で特異的に生じている遺伝子変異のパターンも数百以上が発見されています。しかし、変異を突き止めても、治療の手立てがないという時代が長く続きました。基礎研究と臨床が乖離(かいり)していたのです。患者さんにとっては、どんなに画期的な研究でも、治療に反映されなければ意味がありません。そうした中でブレークスルーとなったのが、ここ20年の分子標的薬の開発でした」
分子標的薬は、がん細胞でのみ遺伝子変異によって活性化し、増殖や転移に関係する分子(タンパク質、酵素)を狙い撃ちする。それぞれが特定の遺伝子変異を標的にしているので、変異を知ることで、どの薬がもっとも効果的かがわかる。つまり、最適の分子標的薬を選択するには、遺伝子検査が欠かせないということになる。
たとえば、肺がんの場合、がん細胞の表面にはEGFRというタンパク質がある。このタンパク質を作る遺伝子に変異があるタイプには、EGFRを阻害する*イレッサ、*タルセバ、同じ肺がんでも、ALK融合遺伝子という遺伝子変異が生じているケースでは、*ザーコリ、*アレセンサ、*ジカディアといった分子標的薬が選ばれる。また、HER2という遺伝子が増幅している乳がんでは、*ハーセプチンが選択肢となる。
「これらの分子標的薬は、EGFR変異、ALK融合遺伝子、HER2増幅などのないがんには効きません。したがって、用いるときには、予め患者さんのがん細胞を調べ、該当する遺伝子異常の有無を調べることが必須なのです。また、最近では遺伝子異常が同じであれば、臓器が異なっても同じ分子標的薬が選択される可能性さえ出てきています」
*イレッサ=一般名ゲフィチニブ *タルセバ=一般名エルロチニブ *ザーコリ=一般名クリゾチニブ *アレセンサ=一般名アレクチニブ *ジカディア=一般名セリチニブ *ハーセプチン=一般名トラスツズマブ
コンパニオン診断から遺伝子パネル検査へ
分子標的薬を使用するために、がん細胞の遺伝子異常を調べる検査を「コンパニオン診断」という。
ただ、従来のコンパニオン診断の場合、一度に調べられるのは1つの遺伝子異常のみで、複数の遺伝子を検査するには時間と費用がかかる。分子標的薬が増えていけば、コストはさらに増える。そこで、これに代わるものとして、最近普及し始めているのが、1度の検査で多数の遺伝子異常を網羅的に調べる「遺伝子パネル検査」だ(図1)。
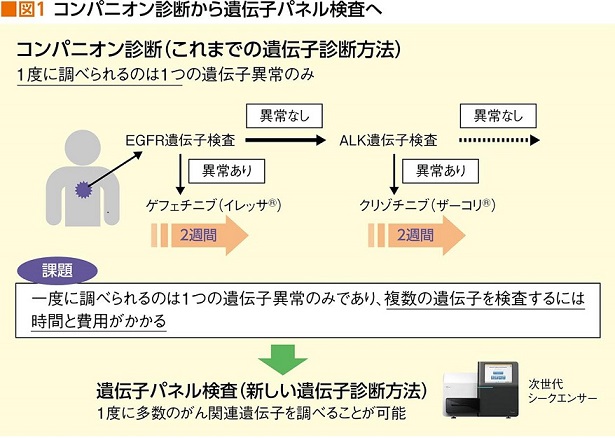
「パネル検査を可能にしたのは、遺伝子の塩基配列を高速に読み取る次世代シーケンサー(NGS)と呼ばれる最先端の解析機器の開発です。これによって、がんに関係する多数の遺伝子変異を短時間で検出し、判明した遺伝子の異常に合わせ、より有効性の高い分子標的薬を選択できるようになりました」
遺伝子パネル検査には複数のコンパニオン診断を同時に行うもののほかに、まだコンパニオン診断としては承認されていないが臨床研究の結果などから治療選択に有用な遺伝子異常の情報をより広く解析する目的のもの(遺伝子プロファイル検査)もあり、現在、国内で実施されている遺伝子プロファイル検査には、先進医療として実施されているNCCオンコパネル(国立がん研究センター中央病院)、東大オンコパネル(東大)や、自由診療として行われているOncoPrime(京大、千葉大他)、P5がんゲノムレポート(岡山大、九大他)などがあります。
検査から結果判明までは約1カ月
では実際に、遺伝子パネル検査を受ける場合には、どのような流れになるのか。ここで簡単に説明しておこう。
検査を希望する患者は、主治医とよく相談して、まず担当の医療スタッフから検査内容について説明を受ける。それに同意すれば、手術や生検で採取したがん組織を、病院から検査実施施設に送られる。ラボではがん細胞から抽出した核酸(DNA・RNA)の塩基配列を読み取り、がん関連遺伝子の変異を同定する。結果は主治医に報告され、患者と相談した上で治療法を決める。現在、がん組織の採取から結果の判明まで1カ月ほどかかるのが普通だ。
「SCRUM-Japan」――がんの患者に有効な治療を届けるために
ところで、この遺伝子パネル検査の対象となるのは、全身にがんが転移したり、希少がんなど、標準治療では治療が望めなくなっている患者がほとんどで、ワラをもつかむ気持ちで検査を希望するケースが多い。これまでの自由診療では、高額な費用がカベとなっていたが、一部が先進医療に指定されたことで、ハードルは少し下がったといえるだろう。
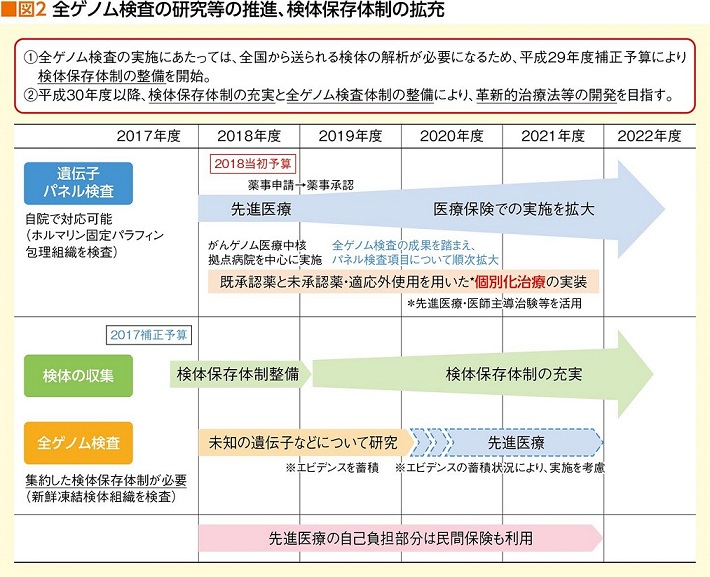
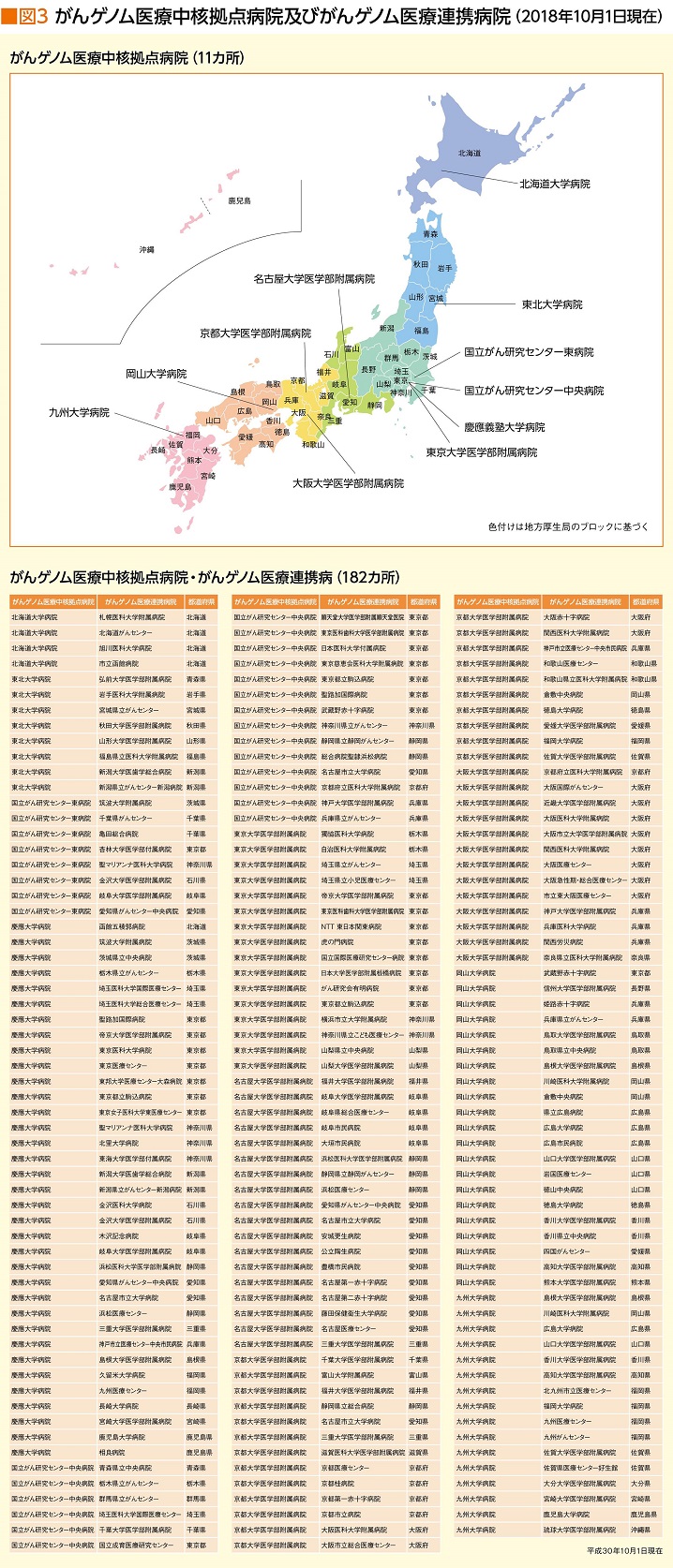
さらに厚生労働省は、2019年までに遺伝子パネル検査を保険適応とする方針を示し、これを軸にゲノム医療提供体制の整備、情報管理センターの設立、研究の推進などの方針を掲げている(図2)。先ごろ、がんゲノム医療中核拠点病院11カ所、がんゲノム医療連携病院182カ所(2018年10月1日現在)を指定したのもその一環だ(図3)。
ただ、遺伝子パネル検査には課題も少なくない。
「1つは、遺伝子異常が検出されても、治療薬がないケースが予測されること。検査をしても治療まで辿りつけなければ、患者さんにとって利益はありません。そのためにも新薬の開発が求められます。もう1つは治験です。たとえ遺伝子異常に合った分子標的薬が見つかっても、そのがんには未承認なら、治験が必要となります。しかし、希少な遺伝子異常では患者数が少なく、治験自体の実施が難しい」
こうした希少な遺伝子異常を持つがん患者に治療を届ける仕組みとして、土原さんたちが立ち上げたのが「SCRUM-Japan」というプロジェクトだ。国立がん研究センターと製薬企業(現在17社)、全国265の医療機関が参加している。
肺と消化器の2グループから成り、患者から採取したがん組織を遺伝子パネル検査で解析し、その結果をもとに、国内で進行中の企業・医師主導治験への登録を推進するシステムである。すでに、肺がんから発見されたRET融合遺伝子に対する*カプレルサ(適応は切除不能の甲状腺髄様がん)の効果を見出している。
土原さんは「SCRUM-Japanは、希少な遺伝子異常を持つがんに対する新薬の開発と治験をより活発にするためのプラットフォーム。より多くの医療機関や企業とスクラムを組んで、さらに取組みを加速していきたい」と話している。
*カプレルサ=一般名バンデタニブ
同じカテゴリーの最新記事
- がんゲノム医療をじょうずに受けるために 知っておきたいがん遺伝子パネル検査のこと
- 重要な認定遺伝カウンセラーの役割 がんゲノム医療がますます重要に
- 「遺伝子パネル検査」をいつ行うかも重要 NTRK融合遺伝子陽性の固形がんに2剤目ヴァイトラックビ
- 遺伝子変異を調べて個別化の最先端を行く肺がん治療 非小細胞肺がんのMET遺伝子変異に新薬登場
- 患者も知っておこう「遺伝子検査」のこと 遺伝子検査を受けるうえで自分の遺伝情報とどう向き合うか
- 日本血液学会が『造血器腫瘍ゲノム検査ガイドライン』を作成 「遺伝子パネル検査」によりゲノム情報は、血液がんの正確な診断・治療に必須
- 遺伝子情報をもとに効果の高い治療法を選択 膵がんにおける遺伝子変異に基づくゲノム医療とは
- 世界的に注目のマイクロRNAを活用したバイオマーカー 血液1滴で大腸がんリンパ節転移を予測、治療のあらゆる場面で利用可能に
- 第25回日本乳癌学会学術総会レポート No.2 シンポジウム「個別化医療における多遺伝子発現検査の現状と展望」



