切除不能大腸がん治療の新しい潮流
切除不能大腸がん治療に及ぼす影響 欧州臨床腫瘍学会で新しい解析データ報告

大腸がんに対する抗EGFR抗体薬(分子標的薬)の投与に関しては、事前に遺伝子検査でKRAS遺伝子変異の有無を確認することが求められている。同遺伝子に変異があると治療効果が期待できないため、他の化学療法薬を使用することになる。
先ごろ、都内で開かれたメルクセローノ社主催のプレスセミナー「切除不能大腸がん治療は変わるのか」では、切除不能大腸がん患者でRAS遺伝子野生(正常)型症例では、抗EGFR抗体薬アービタックス併用による全生存期間(OS)が、抗VEGFR抗体薬アバスチン併用に比べてさらに有意に延長されるとする、欧州臨床腫瘍学会(ESMO2013)での探索的解析結果が報告されるとともに、それに基づく今後の治療展望が語られた。
奏効率、無増悪生存期間には差はないが、全生存期間に差が
昨年(2013年)の米国臨床腫瘍学会(ASCO2013)で報告されたある臨床試験結果が話題を呼んだ。切除不能進行・再発大腸がんに対し、1次治療として位置づけられている化学療法(*FOLFIRI)に、分子標的薬の*アービタックスと*アバスチンをそれぞれ併用した治療群での比較が行われた。
「FIRE-3試験」である。
話題となったのは、分子標的薬同士の初めての直接比較試験(head-to-head試験、いわゆる〝ガチンコ対決〟と呼ばれるもの)であったことと、もう1つは、得られた試験結果が興味深いものであったためである。直接比較試験は相撲で例えると、横綱同士の真剣勝負に似ている。要するに、どちらが優れているか(強いか)はっきりさせることを目的にした試験だからだ。
果たしてその結果は……。
試験の主要評価項目の有効性解析対象(ITT)集団での奏効率(ORR)はアービタックス併用群62・0%、アバスチン併用群58・0%と両群間に有意差は認められなかった。副次評価項目の無増悪生存期間(PFS)はそれぞれ10・0カ月(中央値)、10・3カ月(同)と、こちらもほぼ同様の結果となった。
主要評価項目で差がなかったことから、アービタックスのアバスチンに対する優越性は否定されることになったのだが、他の副次評価項目の1つであった全生存期間(OS)において、アービタックス群28・7カ月(中央値)、アバスチン群25・0カ月(同)と両群間で統計学的に有意な差(p=0・017)が認められた。
この種の臨床試験では、無増悪生存期間では有意差が認められるものの、より重視される全生存期間では差なしといったケースが多く、その逆となったFIRE-3試験結果は臨床医の間で無視できないものとして話題となった。
こうした流れを受けて、昨年10月末にアムステルダムで開かれたESMO2013では、FIRE-3試験のプロトコルに基づき予め計画されていた探索的解析結果が報告された。
今回のセミナーで、この探索的解析結果について、愛知県がんセンター中央病院薬物療法部長/外来化学療法センター長の室 圭さんがその意義を解説した。
*FOLFIRI=5-FU(商品名)+l-ロイコボリン(一般名)+イリテカノン(一般名) *アービタックス=一般名セツキシマブ *アバスチン=一般名ベバシズマブ
より深い腫瘍縮小効果が影響?

室さんはまず、ASCO2013で報告された試験結果、なぜアービタックス併用群で全生存期間が延長したかについて、❶2次治療以降の影響、❷Deepness Response(より深い腫瘍縮小効果)、❸1次治療としてアービタックスを使用することで腫瘍のBiology(生物学)が変化した可能性――の観点から語った。
❶については、両群間で2次治療への移行率の差はなく、使用した薬剤も含めて2次治療以降の影響は考えにくいとした。
❷については、より深い腫瘍縮小効果により2次治療移行時点の腫瘍量が異なるため、その後の予後への影響が考えられることを指摘した。ちなみにFIRE-3試験での奏効内容をみると、完全奏効(CR)率ではアービタックス群13例(4・4%)、アバスチン群4例(1・4%)と有意差が認められている。このため、無増悪生存期間において両群間に差がなくても、より深い腫瘍縮小効果によって全生存期間に差が出る可能性があるという。
❸については、アバスチンの投与歴があると、アービタックスの効果が減弱する可能性などが示唆されており、腫瘍の性質の変化、投与順序による影響の可能性が考えられるという。
RASファミリーの遺伝子変異の有無に拡大して解析
FIRE-3試験では、KRAS野生型切除不能進行・再発大腸がん症例592例を、FOLFIRI+アービタックス療法群(297例)とFOLFIRI+アバスチン療法群(295例)に無作為に割り付け、有効性を検討、前記の試験結果が得られた。
今回の探索的解析では、このKRAS野生型592例の中で、RAS(KRAS、NRASなどRASファミリー)変異解析が可能な患者群407例を対象としたが、342例(84%)はRAS野生型で、65例(16%)は RAS変異を有していることが判明した。
そこでRAS野生型342例を解析した結果、アービタックス+FOLFIRI併用療法群(171例)の全生存期間中央値は33・1カ月であったのに対し、ベバシズマブ+FOLFIRI併用療法群(171例)では25・6カ月と、アービタックス群で7・5カ月延長したことが示された(HR:0・70、p=0・011)(図1)。
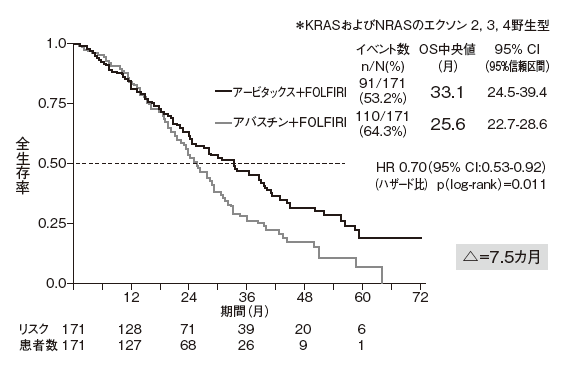
奏効率はそれぞれ65・5%、59・6%と改善、無増悪生存期間は10・4カ月、10・2 カ月(HR:0・93、p=0・54)と同様だった。
このような結果から、切除不能進行・再発大腸がんに対しては、RAS (KRAS、NRAS) 変異の検査が強く推奨されることが示唆された。
RAS検査導入と検査体制の早急な整備が重要
室さんは、RAS野生型患者において、アービタックス+FOLFIRI療法による1次治療は、ベバシズマブ+FOLFIRI療法に比べ全生存期間(中央値)で7・5カ月延長という顕著な差を呈し、優れていたことなどから、
「大腸がん治療において更なる個別化治療の時代を迎えるにあたり、国内におけるRAS検査の導入と検査体制の早急な整備が重要であり、体制が整い次第、患者の治療選択に用いるべきである。現時点において、KRAS野生型の大腸がん患者さんに対して、アービタックスによる生存期間延長のエビデンスを説明し、1次治療の第1選択薬としてアービタックス投与を考慮すべきである」と述べた。
同じカテゴリーの最新記事
- 世界に先駆け初承認された分子標的薬ロズリートレクの課題 共通の遺伝子変異を標的とする臓器横断的がん治療薬
- 進行・再発卵巣がんに選択肢が増える 初回治療から分子標的薬リムパーザが使える!
- 肺がんに4つ目の免疫チェックポイント阻害薬「イミフィンジ」登場! これからの肺がん治療は免疫療法が主役になる
- 肺がん薬物療法最前線―― 分子標的薬と、オプジーボに代表される免疫チェックポイント阻害薬が、肺がん治療をここまで変えた!
- 第3世代タグリッソ登場で非小細胞肺がん治療はさらに進化
- 分子標的薬投入時期を「Window」で見える化 ホルモン陽性HER2陰性再発転移症例での適切な投与時期を示唆
- 非小細胞肺がん 耐性後は再生検を行い 適切なEGFR-TKIで治療する
- 深い寛解後に 70%が投薬中止可能~慢性骨髄性白血病の治療~
- 分子標的薬の皮膚障害は予防と適切な対応でコントロール可能
- 副作用はこうして乗り切ろう!「皮膚症状」



