マウスモデルで体重減少を抑制し、生存期間を延長 ナノ粒子を用いた光線力学療法による腹膜播種治療

これまで胃がんの腹膜播種では抗がん薬が効かなくなると、それ以上打つ手がなかったが、昨年(2014年)11月、光増感剤内包ナノ粒子を用いた光線力学療法(PDT)により、ヒト胃がん細胞を移植したマウスの腹膜播種モデルで体重減少の抑制と生存期間の延長効果が得られたとの報告があり、将来的には食道がんや肺がんなどでも臨床応用が期待されている。
光照射により活性酸素を産生する光増感剤をミセルに封入
胃がんの腹膜転移を「腹膜播種」と呼ぶが、末期胃がん(ステージⅣ)患者の約半数が腹膜播種のために死亡している。腹膜播種に対しては様々な治療が行われているが、使用可能な抗がん薬を全て使い切ってしまうと、それ以降の治療手段はないというのが現状であった。
光線力学療法(PDT)とは患者さんに光感受性物質(光増感剤)を投与し、それががん組織に取り込まれた段階で特定波長の光を照射すると光増感剤が刺激されて蛍光を発すると同時に、殺菌作用や細胞傷害作用を持つ*活性酸素を作り出すことにより、がん細胞を叩くという治療法である。
防衛医科大学校上部消化管外科講師の辻本広紀さんらの研究グループは ㈱島津製作所が開発した「ラクトソーム」という*ミセルにインドシアニングリーン(ICG)という光増感剤を内包させたナノ(1nmは10億分の1m)サイズの粒子である「ラクトソームICG」(ICGm:直径20~100nm)をヒトの胃がん細胞を腹膜に移植したマウス腹膜播種モデルに投与し、その影響を検討した。
その結果、腹部に弱い光を照射した場合はICGの発光が、がん組織に集中して認められ正常組織には見られないことが確認され、強い光を照射した場合は通常のICGだけを投与した群では何も変化が無かったのに対し、ICGm投与群では腫瘍部位へのICGの集積を示唆する強い蛍光が認められた。
また、その結果としてICG投与群に比べICGm投与群では明らかに腹膜播種が縮小し、体重減少が抑制され、生存期間も延長した(図1~3)。


図3 腹膜播種結節の総重量と結節数の比較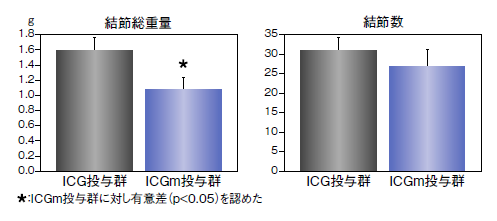
*活性酸素=酸素分子がより反応性が強い化合物に変化した物質の総称で、非常に強い酸化作用を持つ。一重項酸素、ヒドロキシルラジカル、過酸化水素などがある *ミセル=分子同士の引っ張り合う力で形成される多数の分子の集合体
腹膜播種の診断と治療が同時に可能
ICGのような光増感剤は弱い光を照射すると蛍光を発生する性質を持つので、従来は検査や診断に用いられてきたが、強い光、例えば低エネルギーのレーザー光などを照射すると強い蛍光を発し、そのエネルギーによって活性酸素を産生する。
ただICGは分子量が小さいため、そのままではごく短時間のうちに全身に広がり、肝臓に取り込まれて代謝され、体外に排出されてしまう。今回、ICGを大きな分子量のラクトソームに内包させることにより、体内に長時間滞留させることが可能になり、活性酸素によるがん組織への効果を高めることができた。
腹膜播種診断と光線力学療法(PDT)
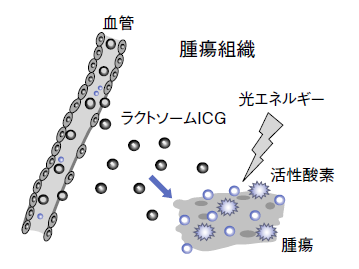
また、ICGmががん組織のみに集まるのは、がん組織では血管透性の亢進といって、正常血管に比べ血管壁の隙間が大きくなっているため、ICGmがこの隙間を通り抜けてくるからだ。しかし、正常な組織では血管壁の隙間が小さく外へ出ることができない。これをEnhanced Permeability and Retention(透過性と滞留性増強)効果、略してEPR効果という(図4)。
辻本さんは「この方法はこれまで困難であった腹膜播種の診断と治療の両方を行えるのが最大のメリットです。ICGは心臓や肝臓の機能検査等で私たちが毎日のように使っている色素ですし、ICGを内包しているミセル(ラクトソーム)もその安全性が確立しつつあります」と安全性の高さを強調している。
同じカテゴリーの最新記事
- 口腔ケアでがん転移抑制の可能性も! 虫歯菌による血管炎症で血栓症・がん転移が増える
- 失われた機能とQOLを取り戻すため骨転移は積極的に治療を! 『骨転移診療ガイドライン』改訂版は多職種の参加で作成
- 脇腹の痛みが続いたら要注意! 増えている骨転移
- がんによる急変には、患者は何を心得ておくべきなのか オンコロジック・エマージェンシー対策
- 高齢者機能評価ツールを用いて判断できる可能性 進行再発がんの薬物治療〝進め方と止めどき〟
- 進行・再発がんでケトン食療法が有効か!? 肺がんⅣ(IV)期の介入研究で期待以上の治療成績が得られた
- 「骨を守る」対策も並行して行う乳がん骨転移治療 日常活動動作や生活の質を維持するために
- 再発・転移特集/再発・転移の基礎知識
- いかに手術に持ち込めるかがカギ 大腸がんの肝転移治療戦略 肝切除においては肝臓の機能、容積の確保が重要
- 分子標的薬、サイバーナイフなど肺がん脳転移しても治療法はある 分子標的薬や放射線療法の進化で治療が大きく進歩



