肺がん個別化医療に関する特別インタビュー
肺がんは特定の遺伝子異常を確認して治療を選択する個別化医療の時代に
自分のタイプに合った薬に出合うために遺伝子診断を受けよう!
 中西洋一(なかにし よういち)
中西洋一(なかにし よういち)
九州大学大学院呼吸器内科学分野教授
1980年九州大学医学部卒業。佐賀医科大学助手、九州大学助手、同講師、同助教授を経て、2003年より教授。2010年九州大学主幹教授となる。現在、日本呼吸器学会理事、日本肺癌学会理事長を務める
 間野博行(まの ひろゆき)
間野博行(まの ひろゆき)
自治医科大学分子病態研究センターゲノム機能研究部教授/東京大学大学院医学系研究科ゲノム医学講座特任教授
1984年東京大学医学部卒業。同大学附属病院、自治医科大学附属病院に研修医として勤務。その後東京大学内科に入局。1993年より自治医科大学医学部分子生物学講師、助教授を経る。2001年より自治医科大学ゲノム機能研究部教授、2009年より東京大学大学院医学系研究科ゲノム医学講座特任教授を兼務。肺がん原因遺伝子EML4-ALKの発見と臨床応用により2012年の紫綬褒章を戴く
非小細胞肺がんの中でも、腺がんで見つかっている2つの遺伝子異常、EGFRとEML4-ALK。この遺伝子異常に作用する薬であるイレッサ*とザーコリ*は、がんの原因を直接攻撃するため、遺伝子異常がある患者さんには驚きの効果を発揮する。まずはこれらの異常があるかどうかを遺伝子検査で確認し、異常がある場合にはそれに適した薬を使う。肺がんはすでに個別化医療の時代を迎えている。
*イレッサ=一般名ゲフィチニブ *タルセバ=一般名エルロチニブ
がんの原因遺伝子を特定し、選択的にブロックする薬ができてきた
――がん医療の分野で最近、「遺伝子診断」という言葉が聞かれるようになりました。肺がんでは遺伝子診断はなぜ行われ、どんなメリットがあるのでしょうか。
中西 がん細胞は遺伝子の異常によって生まれ、増殖します。どの遺伝子のどこに異常があるのかを特定し、その働きをブロックすることでがん細胞の増殖を止める治療法が、肺がんではすでにいくつか確立しています。
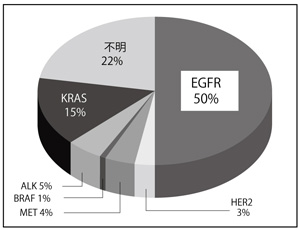
その代表が、上皮成長因子受容体(EGFR)の遺伝子異常であり、これをブロックする分子標的薬がイレッサ、タルセバ*です。アジア人にはもともとEGFRの遺伝子異常が多いことが知られていますが、その中でも日本は、検査も治療も健康保険で受けることができる唯一の国です。これは世界に先駆けた画期的なことです(図1)。
――間野さんによるEML 4-ALK融合遺伝子の発見は、遺伝子診断によるがん治療をさらに進展させ、その功績により紫綬褒章も叙勲されました。EML4-ALK融合遺伝子について教えてください。
間野 ヒトの細胞の核には染色体があり、じつに2万数千種類ものタンパク質をつくり出しています。そのうちのほんのわずかなタンパク質が細胞の増殖を司っていますが、その1つがALKという酵素です。
染色体上のこのALKという酵素の遺伝子がある場所が切れて、別のEML4という遺伝子とくっつき、EML 4-ALK融合遺伝子ができることを、私たちは発見しました。ALKは正常な細胞の増殖を司る酵素ですが、EM L4と融合することで活性が数百~数千倍になり、その結果、異常な細胞が際限なく増え、肺がんを引き起こします。
細胞増殖を異常に活性化する遺伝子を「がん遺伝子」と言います。がんはこの遺伝子に依存しなければ生きられません。逆に言うと、この酵素の活性をブロックする薬を使うことで、がん細胞はあっという間に死ぬ。事実、EML 4-ALK融合遺伝子の有無を調べる検査で陽性と出た患者さんにALK阻害薬を投与すると、ときに夢のようなと言って差し支えない治療効果があることがわかりました。
承認プロセスをも変えた画期的な新薬
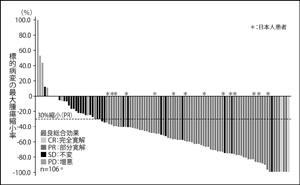
※早期死亡および評価不能であった8例を除く(2010年11月時点までの中間集計)
――その薬とはザーコリ*ですね。米国で2011年8月、日本でも昨年(2012年)3月に承認されました。
中西 日本には「ドラッグ・ラグ」と呼ばれる問題があります。どんなに素晴らしい薬が世界で開発されても、日本になかなか導入されず、大きなタイムラグ(時間差)があるのです。
しかし、ザーコリは他の国とほぼ足並みを揃えて日本でも使用できるようになりました。ザーコリはEML4-A LK融合遺伝子を持つ人に非常に切れ味がいい。その上、この融合遺伝子を持つ人は他に効果的な治療法がない場合が多いので、まさに福音でした。
もう1つ、一般に肺がんは年配の喫煙者に多いのですが、EML4-ALK融合遺伝子を持つ患者さんには、若くてタバコを吸わない方もたくさんいます。こうした若い患者さんによく効く薬が早く使えるようになったのは、臨床の人間として非常に嬉しい点です。
――研究・開発の間野さんのお立場ではいかがですか?
間野 私たちがこの遺伝子を報告したのは2007年でしたが、米国では4年、日本でもたった5年で承認されました。しかも、ザーコリの臨床試験と承認のプロセスは、従来の新薬と大きく違っていると思います。
第一に、最初の臨床試験(第一相試験)に入るとき、患者さんをEML 4-ALK融合遺伝子を持つ患者さんに限ったこと。結果、極めて短期間に比較的少人数の患者さんで薬の顕著な有効性が証明されました。
また、通常の臨床試験は最後に従来の標準的な治療と比較する第3相試験を行いますが、この薬は第1、2相試験の結果だけで米国で承認されました(図2)。
これも画期的な出来事です。これほど有効な薬であれば、二重盲検法*による長期間にわたる多数の患者さんの臨床試験を行うと、逆に一般の患者さんに薬が届くのを遅らせることになるとの英断だったと思います。
このことは、今回のALK阻害薬のようにがんの根本的な原因を抑える薬の今後の臨床試験のあり方を大きく変えた、歴史的瞬間だったと思います。ただし、こうしたアプローチの問題点は、多数の患者さんにおける副作用データがそろっていないことです。その意味では、薬が承認・販売されたあとも患者さんをきめ細やかにフォローし、副作用の正確な情報を集め、それを広めることが大切です。
*ザーコリ=一般名クリゾチニブ
*二重盲検法=偽薬(プラセボ)によるプラシーボ効果(思い込み効果)をなくすため、医師にも患者にもどちらが試験薬でどちらが薬効の無い偽薬か、わからないようにして、臨床試験を進める方法
同じカテゴリーの最新記事
- 薬物療法は術前か、それとも術後か 切除可能な非小細胞肺がん
- Ⅳ期でも治癒の可能性が3割も! 切除不能非小細胞肺がんの最新治療
- 肺がん治療の最新トピックス 手術から分子標的薬、免疫チェックポイント阻害薬まで
- 遺伝子変異を調べて個別化の最先端を行く肺がん治療 非小細胞肺がんのMET遺伝子変異に新薬登場
- 分子標的薬の使う順番の検討や併用が今後の課題 さらに進化している進行非小細胞肺がんの最新化学療法
- 肺がんⅢ期の化学放射線療法後にイミフィンジが効果 放射線副作用の肺臓炎をいかに抑えるかが重要
- 体重減少・食欲改善の切り札、今年いよいよ国内承認か がん悪液質初の治療薬として期待高まるアナモレリン
- 肺がんに4つ目の免疫チェックポイント阻害薬「イミフィンジ」登場! これからの肺がん治療は免疫療法が主役になる
- ゲノム医療がこれからのがん治療の扉を開く 遺伝子検査はがん治療をどう変えるか
- 血管新生阻害薬アバスチンの位置づけと広がる可能性 アバスチンと免疫チェックポイント阻害薬の併用が未来を拓く



