遺伝子変異と左右どちら側にがんがあるかが、薬剤選択の鍵を握る! 大腸がん薬物療法最前線

今年1月、「大腸癌治療ガイドライン第7版(2022年版)」が刊行された。2019年の第6版からおよそ3年。その間にも、臨床試験によるエビデンスを基に、新たな治療法や薬剤が登場している。それら最新知見を速やかに臨床現場に届け、日々の治療に活用できるようにする指針がガイドラインだ。
ガイドライン最新版から見えてくる、切除不能の大腸がんに対するこれからの薬物療法について、がん研有明病院消化器化学療法科部長の山口研成さんに話を聞いた。
薬物療法を始める前に大切なこと
「切除不能の進行がんであることがわかったとき、大腸がんに関わらず、まず考えなくてはならないのは、患者さん自身の体の状態です」
がん研有明病院消化器化学療法科部長の山口研成さんは、そう口火を切った。
〝切除不能なら薬物療法〟と考えがちだが、「そうではない」と山口さんは言う。
「まず、患者本人の体力、合併症の状況、年齢など、あらゆる情報と状態を考え合わせ、抗がん薬治療に耐えうる体の状態かどうかを判断しなくてはなりません。年齢は判断材料の1つに過ぎず、たとえ高齢でも、抗がん薬治療に耐える体力があると判断できれば薬物療法はもちろん可能です」
薬物療法へ進むことになったら、大腸がんの場合、まず行うのが「遺伝子検査」。RAS、BRAF、そしてMSI-H(High)の3つの遺伝子検査を1次治療前に行うことが、今回、新たにガイドライン(第7版)に記載された。
薬物療法は、3つの遺伝子検査を行ってから
RAS遺伝子、BRAF遺伝子の変異の有無によって1次治療時に追加する分子標的薬に違いが出るため、この2つの遺伝子検査は1次治療前に行う施設が増えている。そこに今回、MSI検査も同じタイミングで追加することが推奨された。
これは、昨年(2021年)8月、「KEYNOTE177試験」結果によって、MSI-H陽性の切除不能大腸がんの1次治療として抗PD-1抗体キイトルーダ(一般名ペムブロリズマブ)が承認されたことを受けている。
「RAS遺伝子とBRAF遺伝子は『RASKET-B』という1つのキットで同時に調べることができます。MSI検査にもキットが登場したので、これらのキットを使って、1次治療前にRAS、BRAF、MSI-Hの3つの遺伝子変異を調べる検査を行い、その結果によって1次治療の内容が決まるという流れです。この流れが、1日も早く全国どこの施設でも当たり前になってほしいと思っています」
MSI-H陽性なら1次治療から免疫チェックポイント阻害薬
MSI-H陽性は、切除不能大腸がんのおよそ4%。頻度は低いものの、もし該当すれば、1次治療から免疫チェックポイント阻害薬のキイトルーダが効果を表す可能性が高い。
また、2次治療では同じ抗PD-1抗体のオプジーボ(一般名ニボルマブ)と抗CTLA-4抗体ヤーボイ(同イピリムマブ)の併用療法も承認されている。さらに、MSI-Hは術後の再発リスクが低いこともわかっているので、切除した後の大腸がんでも、MSI-Hであることを知るメリットは大きいと言えるだろう。
RAS遺伝子、BRAF遺伝子に変異がないなら、決め手は発生位置
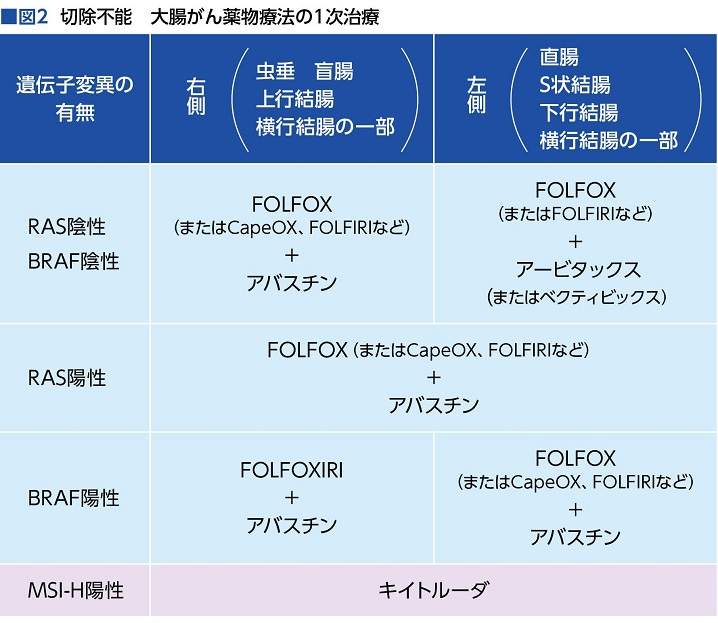
RAS遺伝子、BRAF遺伝子ともに野生型(変異なし)の場合、1次治療は原発巣の位置によって、薬剤選択が変わってくるそうだ。
「実は、同じ大腸がんでも、発生位置が左側(さそく)か右側(うそく)かによって、がん自体の性質が大きく違うことがわかってきました。そのため、抗がん薬の反応も効果も左右で違い、予後も変わってくることが明らかになったのです」
つまり、薬剤を選択するにあたって、大腸がんの発生位置が左側か右側かが決め手の1つになるのだ。
直腸、S状結腸、下行結腸、横行結腸の左半分といった大腸の左側に発生した大腸がんには抗EGFR抗体が高頻度で効果を発揮するので、1次治療として*FOLFOX(または*FOLFIRIなど)+抗EGFR抗体アービタックス(一般名セツキシマブ)を選択する。アービタックスの代わりに、同じく抗EGFR抗体のベクティビックス(同パニツムマブ)が使われる場合もある。
一方、虫垂、盲腸、上行結腸、横行結腸の右半分といった右側に発生した大腸がんには抗EGFR抗体の効果がほぼ期待できないため、1次治療はFOLFOX(または*CapeOXやFOLFIRIなど)+血管新生阻害薬アバスチン(同ベバシズマブ)となる(図1)。
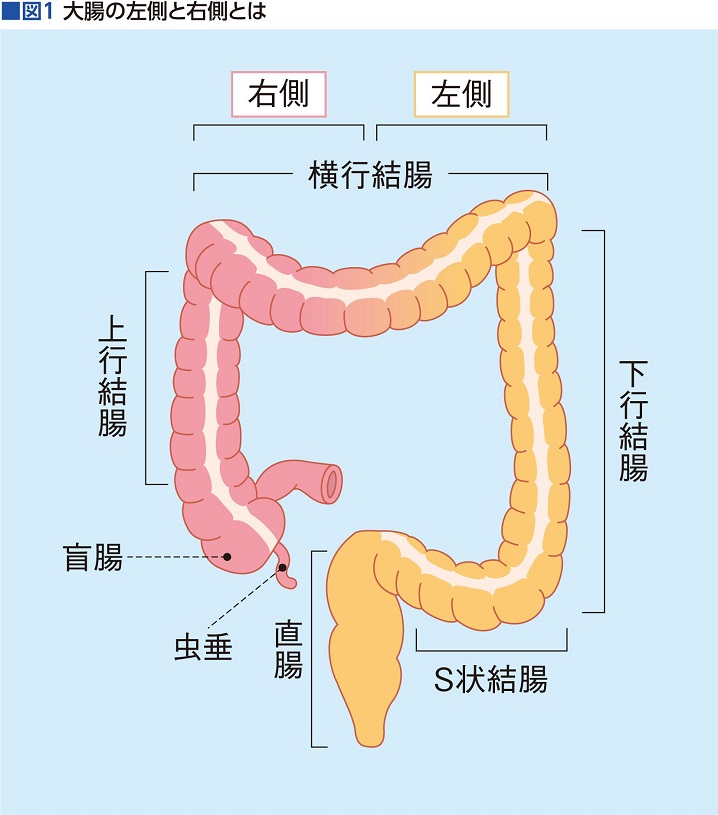
発生頻度は、大腸がんのおよそ70%が左側で、右側が約30%。「抗がん剤治療においては右側のほうが予後が悪い」と山口さんは指摘する。右側にアバスチンを追加するのは、抗EGFR抗体が使えないからだけでなく、血管新生阻害薬を加えることでFOLFOX療法の効果を最大限に高める狙いがあるのだ。
*FOLFOX:5-FU(一般名フルオロウラシル)+レボホリナート(商品名ロイコボリン、アイソボリン)+エルプラット(一般名オキサリプラチン)の併用療法
*FOLFIRI:5-FU(一般名フルオロウラシル)+レボホリナート(商品名ロイコボリン、アイソボリン)+イリノテカンの併用療法
*CapeOX:ゼローダ(一般名カペシタビン)+エルプラット(同オキサリプラチン)の併用療法
RAS遺伝子、BRAF遺伝子に変異がある場合の1次治療
RAS遺伝子、BRAF遺伝子の変異の有無も、薬剤選択の大きな鍵となる。
大腸がんに最も多いのがRAS遺伝子変異で、「切除不能大腸がんの約50%に認められる」とのこと。RAS遺伝子変異陽性の1次治療はFOLFOX(またはCapeOXやFOLFIRIなど)+アバスチン、そしてBRAF遺伝子変異陽性ならばFOLFOX(またはCapeOXやFOLFIRIなど)+アバスチン、もしくは*FOLFOXIRI+アバスチン。RAS、もしくはBRAF遺伝子に変異がある場合、左側右側を問わず、1次治療で抗EGFR抗体を使うことはできない。
それはなぜなのか。
RASもBRAFも、細胞増殖を担う最強シグナルとして現在も研究され続けているMAPK(マップキナーゼ:分裂促進因子活性化タンパク質キナーゼ)経路の下流シグナルの1つ。これらの遺伝子に変異が起こると、異常タンパクが作られ、無秩序な細胞増殖が始まるので、がんの発生を強く促してしまう。一方で、もう1つのがん発生メカニズムである細胞表面の上皮成長因子受容体(EGFR)は上流シグナルだ。
「抗EGFR抗体は、細胞表面の受容体にくっついて、上流のがん細胞増殖を抑えるメカニズムを持つ薬剤です。ところが、すでにRASやBRAFといった遺伝子に変異が起こり、下流でがん増殖シグナルが出ていたら、いくら上流で抗EGFR抗体が上流シグナルを止めても、下流のがん増殖を止めることはできないのです」
つまり、RASやBRAF遺伝子の変異が陽性の場合、抗EGFR抗体の効果は期待できない。よって、RAS遺伝子変異陽性の1次治療は、左側右側を問わず、FOLFOX(またはCapeOXやFOLFIRIなど)+アバスチン。BRAF遺伝子陽性の1次治療は、同じく左側右側を問わず、FOLFOX(またはCapeOXやFOLFIRIなど)+アバスチン、もしくは、FOLFOXIRI+アバスチンとなる。
「RASやBRAFの変異は下流シグナルのため、タチが悪いのです。とくにBRAF変異が強烈で、がんの増殖が速く、腹膜に散らばりやすいうえ、脳に転移しやすいといった特徴があります。だから、抗がん薬の最大パワーで抑えにいくわけです。それがFOLFOXIRI+アバスチン。5-FU(一般名フルオロウラシル)、ロイコボリン(同ホリナートカルシウム)、オキサリプラチン、イリノテカンという、ラーメンで言うと〝全部載せ〟みたいな方法で立ち向かいます」(図2)
*FOLFOXIRI:5-FU(一般名フルオロウラシル)+レボホリナート(商品名ロイコボリン、アイソボリン)+エルプラット(一般名オキサリプラチン)+イリノテカンの併用療法
同じカテゴリーの最新記事
- 「積極的ポリープ摘除術」で大腸全摘の回避を目指す! 代表的な遺伝性大腸がん——リンチ症候群と家族性大腸腺腫症
- 切除可能な直腸がん試験結果に世界が注目も 日本の標準治療は「手術」で変わりなし
- ビタミンDの驚くべき効果がわかってきた 消化管がん手術後の再発・死亡リスクを大幅に減少
- 世界最大規模の画期的研究の一部解析結果が発表 大腸がんの術後補助療法の必要性をctDNAで判断する
- 初めての前向き試験で抗EGFR抗体薬の信頼性が確実に! 進化を続ける切除不能・進行再発大腸がんの薬物療法
- 化学放射線と全身化学療法を術前に行うTNT療法が話題 進行下部直腸がん 手術しないで完治の可能性も!
- 肛門温存の期待高まる最新手術 下部直腸がんTaTME(経肛門的直腸間膜切除術)とは
- 大腸のAI内視鏡画像診断が進化中! 大腸がん診断がより確実に
- 患者さんによりやさしいロボット手術も登場 新しくなった大腸がんの手術と薬物療法



