がんゲノム医療をじょうずに受けるために 知っておきたいがん遺伝子パネル検査のこと

がんの原因となった遺伝子に起きている変異を特定し、それをターゲットにがん細胞を狙い撃ちするがんゲノム医療は、がん医療最前線の治療です。この医療を受けるにはがん遺伝子パネル検査を受けることが必要です。そのがん遺伝子パネル検査は、2019年6月から健康保険で受けられるようになり、検査件数は増え続けています。
そこで本人が希望するがんゲノム医療を受けるために、その前提となるがん遺伝子パネル検査について、がん研有明病院臨床遺伝医療部長の植木有紗さんに解説していただきました。
がん遺伝子パネル検査ってどんな検査ですか?
がんの原因にはタバコ、ホルモン、ウイルス、放射線の被ばく、加齢など、さまざまな原因があるといわれていますが、中には持って生まれた遺伝子の変化によって発がんのリスクが高まる人もいます。しかし、その発がんの要因のほとんどは外的な要因により遺伝子にキズがつき、それが蓄積されることでがんが発生すると考えられています。
たとえば、図1は大腸がんを例にとり、発がんのメカニズムを簡単に解説したものです。正常な大腸粘膜のAPC遺伝子に変異が起こると、過剰な増殖(過形成)を起こします。その状態のときにKRAS遺伝子に変異が起こると腺腫をつくり、さらにいくつかの遺伝子変異が積み重なることでがんになります。APC遺伝子もKRAS遺伝子も細胞の増殖を制御する働きがありますが、この遺伝子に変異が起きると細胞増殖のコントロールが利かなくなると考えられています。このように、変異してがんの増殖などに関与するようになった遺伝子をドライバー遺伝子と呼びます(図1)。
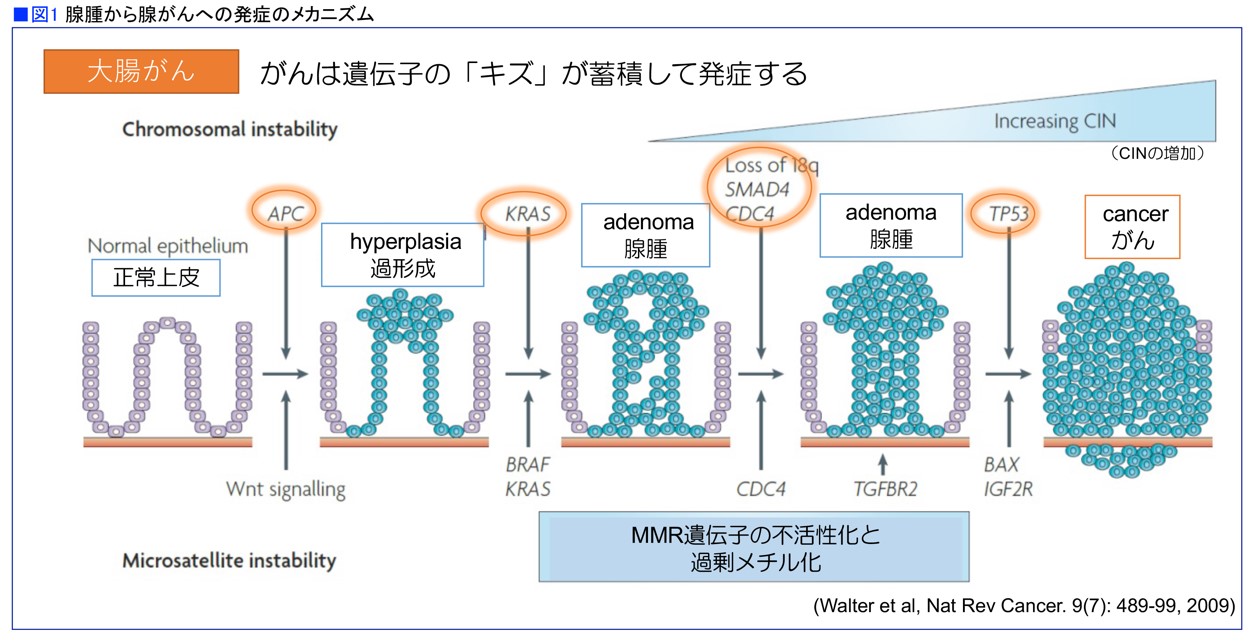
近年、がん治療薬の中心となっている分子標的薬は、これらのドライバー遺伝子を標的とする薬剤です。ドライバー遺伝子の働きをコントロールしてがん細胞の増殖を抑えるので、高い効果が期待されます。逆に言うと、標的にした遺伝子に変異のない患者さんには効果がないので、その有無を調べて薬剤を使うことが必要です。
分子標的薬の開発と共に増えたのが、がんにおけるドライバー遺伝子の有無を調べ治療薬剤の適応を判断する検査「コンパニオン診断」です。たとえば、非小細胞肺がんではEGFRやALK、BRAFなど8種類のドライバー遺伝子が解明されていて、それに合う分子標的薬を使用するためには、それぞれの遺伝子に変異があるかどうか、コンパニオン診断を行う必要があります。
そんな中、高速で大量のゲノム(遺伝子と遺伝情報)を読み取る解析装置「次世代シークエンサー」が登場しました。1回の検査で数百の遺伝子を調べることができるので、がん細胞に起きている遺伝子変異を一度に確認することができます。この検査が「包括的ゲノムプロファイリング検査」、通称「がん遺伝子パネル検査」です。
がん遺伝子パネル検査の目的は、まさに*ゲノムプロファイリングに基づいて、発がんのドライバーになっている遺伝子変異を同定し、それを標的とした薬剤を見つけることです。それががんゲノム医療です。
かつて、患者さん1人ひとりの状態に合ったがん医療の必要性が叫ばれ、オーダーメイド医療と呼ばれましたが、最近はプレシジョン・メディシン(Precision Medicine:精密医療)という言葉が用いられます。米国でオバマ大統領がその推進を呼びかけたことで知られ、個別化医療といわれることもあります(図2)。
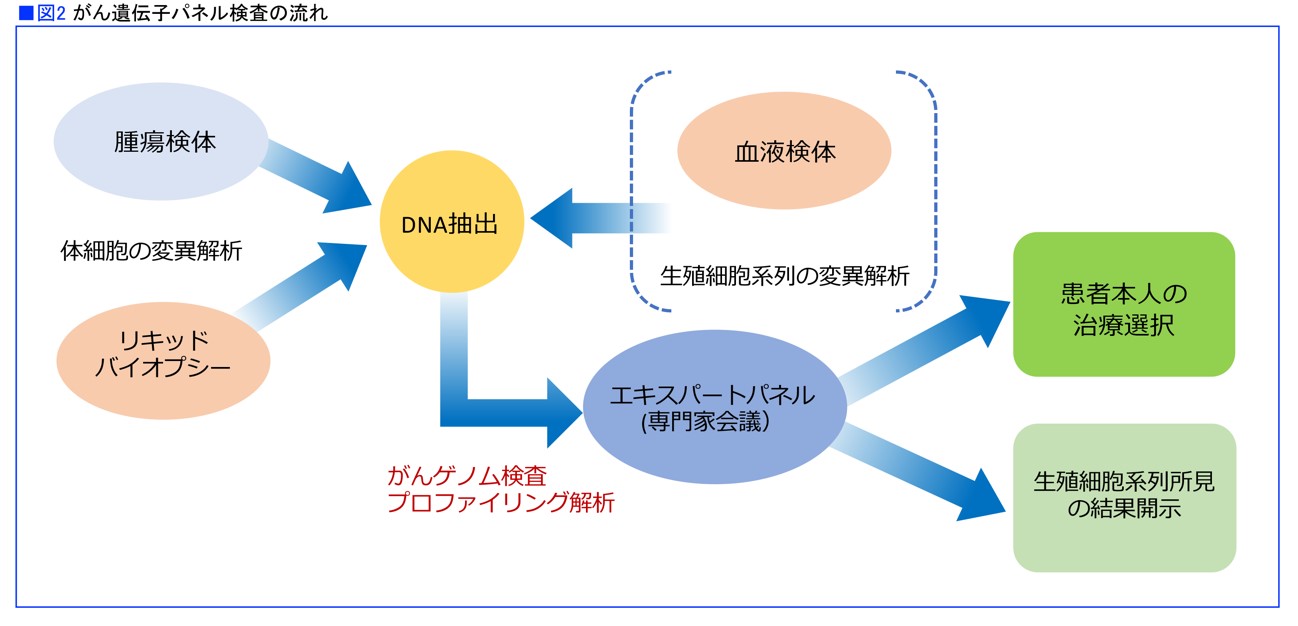
*ゲノムプロファイリング=ヒトにおける全遺伝子の発現と遺伝子変異に関する情報のこと
検査はがん患者さんなら誰でも受けられるのですか?
日本では2019年、がん遺伝子パネル検査が保険診療で受けられるようになりました。これはがん医療にとって大きな出来事だったと思います。そして、この4年半ですでに6万人を超える患者さんが検査を受けています(2019年6月~2023年10月)。
下記の条件に当てはまるがん患者さんは、本検査を保険診療で受けることができます。
標準治療がない(希少がん・小児がん)、または、局所進行もしくは転移があり、標準治療を終了した(終了見込みを含む)固形がんの患者さんで、次の新たな薬物療法を希望されている場合。
現時点では、固形がんが対象で、血液がんは対象になっていません。また、全身状態などの悪化によって、その先の治療がむずかしいと判断された場合などには、検査を受けられないことがあります。
「がん細胞を選択的に叩ける薬剤があるなら」と、がんになってすぐ検査を受けたいと思っても、その段階では残念ながら検査は受けられません。現在は、まず標準治療を受け、それらが終わった後に、さらなる次の治療を探すための検査という位置付けです。
乳がんのように治療薬の多いがんでは、がん遺伝子パネル検査の受検機会が少なく、肺がんも同様です。肺がんは分子標的薬による治療がもっとも進んでおり、コンパニオン診断も多数保険適用になっています。がん遺伝子パネル検査をしなくても、ドライバーを同定して治療につなげる治療がすでにできているのです。
逆に、膵がんのようにドライバー遺伝子の数や標準治療が少なかったり、病勢の進行が早い場合には、「終了見込み」とみなして、主治医が早めにがん遺伝子パネル検査を行なっているケースも多いようです。このように臓器ごとにがん遺伝子パネル検査を検討する場面は異なります。
どんな種類のがん遺伝子パネル検査があるのですか?
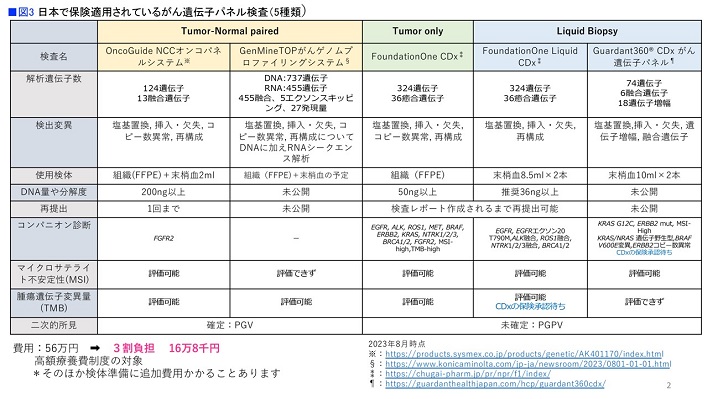
現在、日本で保険適用されているがん遺伝子パネル検査は5種類あります。大きく分けると、以下の3つに分類できます。
①腫瘍検体と血液検体の両方を使うもの
②腫瘍検体だけを使うもの
③血液検体を使うLiquid Biopsy(リキッド・バイオプシー)
日本で最初に使われ始めたのは、国内で開発された①の「OncoGuide NCCオンコパネルシステム」です。解析遺伝子数は137と少なく、コンパニオン診断もFGFR2しか保険適用されてない点に注意が必要です。しかし、組織片と血液を検体として比較検討できるため、がん細胞の中だけの変異なのか、生まれつきの変異なのかが弁別できるなどの特徴もあります。
国内でいちばん使われているのは②の「FoundationOne CDx」(ファウンデーション・ワン)です。解析遺伝子数が324と多いうえ、多くのコンパニオン診断として使えることが強みです。当院で90%、日本全体でも多くのがん遺伝子パネル検査受検者がこれまでFoundationOne CDxを選択してきました。
そうした状況に新たな一石を投じつつあるのが「GenMineTOP」(ジェンマイン・トップ)です。2023年8月から使えるようになった、日本発の新しい検査です。もともとは東大オンコパネルと呼ばれ、東京大学と国立がん研究センターが共同で開発しました。解析遺伝子数がFoundationOne CDxの倍の737で、なおかつRNAも調べることができ、どのようなメカニズムでタンパク質合成に支障をきたしているのかといった、非常にくわしい情報まで解析できると期待されています。
③のリキッド・バイオプシーは、血液などの体液サンプルで検査する方法で、膀胱がんなら尿、脳腫瘍なら髄液など、腫瘍由来の液体を材料としても検査できます。現状では、血液を検体とする2種類の検査が保険適用となっています。
がんの毛細血管は突貫工事の雑なつくりのため、がん由来のDNAがこぼれ出ており、これをctDNA(circulating tumor DNA)といいます。リキッドバイオプシーはこの微少なctDNAを検出して調べます。
リキッド・バイオプシーは手術時の腫瘍組織と違い、採血した時点での最新情報が手に入るという大きな利点があります。一方、手術で腫瘍を切除した直後や抗がん薬治療の効果が高いときなどはほとんど血中にctDNAが流れ出ないので、検査のタイミングに注意が必要です。
ただ現時点では、リキッド・バイオプシー検査が実施できるのは必要な量の腫瘍組織がない場合に限ります(図3)。
同じカテゴリーの最新記事
- 正確な診断には遺伝子パネル検査が必須! 遺伝子情報による分類・診断で大きく変わった脳腫瘍
- 重要な認定遺伝カウンセラーの役割 がんゲノム医療がますます重要に
- 「遺伝子パネル検査」をいつ行うかも重要 NTRK融合遺伝子陽性の固形がんに2剤目ヴァイトラックビ
- 遺伝子変異を調べて個別化の最先端を行く肺がん治療 非小細胞肺がんのMET遺伝子変異に新薬登場
- 患者も知っておこう「遺伝子検査」のこと 遺伝子検査を受けるうえで自分の遺伝情報とどう向き合うか
- 日本血液学会が『造血器腫瘍ゲノム検査ガイドライン』を作成 「遺伝子パネル検査」によりゲノム情報は、血液がんの正確な診断・治療に必須
- 遺伝子情報をもとに効果の高い治療法を選択 膵がんにおける遺伝子変異に基づくゲノム医療とは
- ゲノム医療がこれからのがん治療の扉を開く 遺伝子検査はがん治療をどう変えるか
- 世界的に注目のマイクロRNAを活用したバイオマーカー 血液1滴で大腸がんリンパ節転移を予測、治療のあらゆる場面で利用可能に



