「遺伝子パネル検査」をいつ行うかも重要 NTRK融合遺伝子陽性の固形がんに2剤目ヴァイトラックビ

砂川 優さん
共通の遺伝子変異があれば、がん種にかかわらず効果が期待できる臓器横断的治療薬として、2021年3月、TRK阻害薬ヴァイトラックビが承認された。TRK阻害薬としては2剤目だ。日本で初めてのTRK阻害薬ロズリートレクが、「NTRK融合遺伝子陽性の進行・再発固形がん」に承認されたのは2019年6月。
先行の薬剤との違いや、薬剤を使えるか調べる遺伝子パネル検査について、聖マリアンナ医科大学病院腫瘍内科部長/腫瘍センター長の砂川優さんに伺った。
NTRK遺伝子異常を認める固形がんに効く薬
「NTRK(神経栄養因子チロシンキナーゼ受容体)遺伝子」は、神経細胞の分化や維持に関わるTRKタンパク質を産生する。ところが、固形がんの中には非常に希ではあるが、NTRK遺伝子の一部が何らかの原因で別の遺伝子とくっついた(融合)、「NTRK融合遺伝子」となり、異常なTRK融合タンパク質を産生する。それが、ATP(アデノシン3リン酸)と結合して、がん細胞増殖指令を出し続けるため、がん細胞がどんどん増えてしまう(図1)。
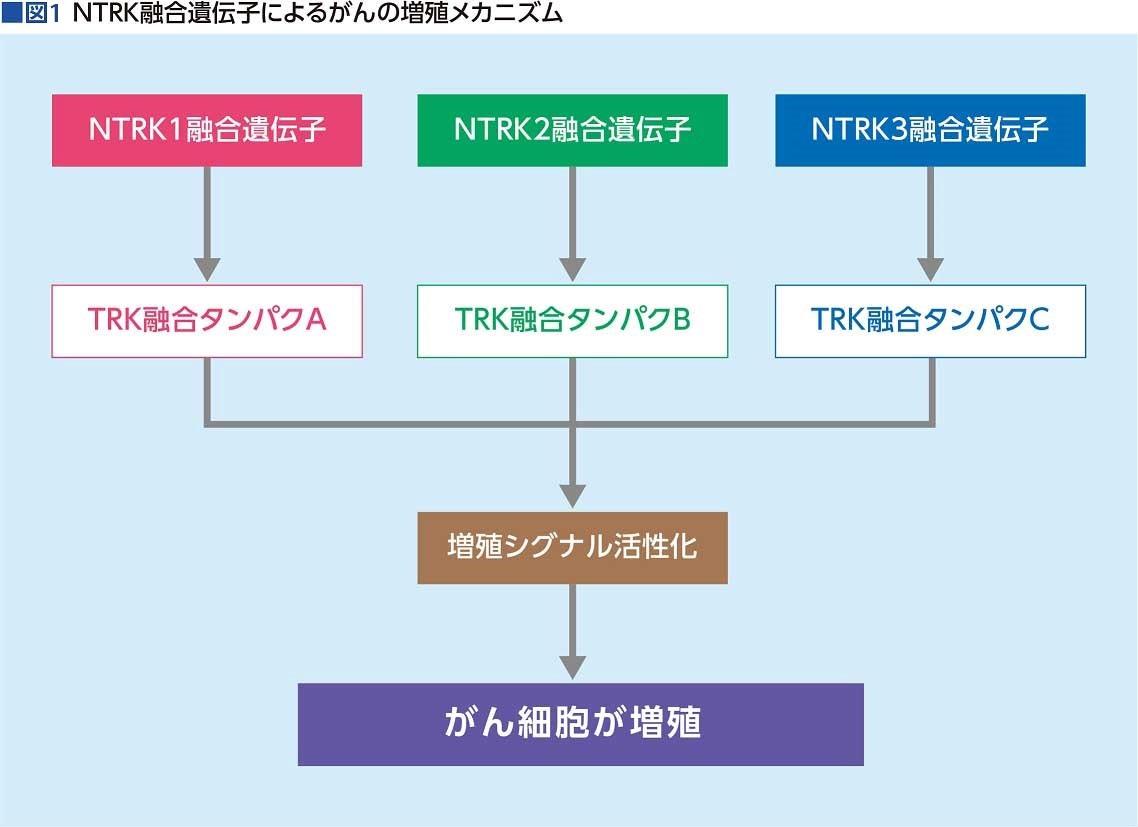
TRK阻害薬は、TRK融合タンパク質に結合し、ATPをブロックすることでがん細胞の増殖を抑える薬だ。当然、この薬が効くためには、NTRK遺伝子が融合という変化を起こしていなければならない。したがって、治療前にその変異があるかを調べる必要がある。
日本で最初のTRK阻害薬ロズリートレク(一般名エヌトレクチニブ)が「NTRK融合遺伝子」陽性の進行・再発固形がんに対して承認されたのと同じ2019年6月、NTRK融合遺伝子の有無を調べる遺伝子パネル検査(コンパニオン診断)が承認されたのもそのためだ。
このように、特定の遺伝子異常を調べて行うがん治療、いわゆる「がんゲノム医療」は現在、最もホットな最先端治療として注目されている。特定の遺伝子異常があれば、がん種を問わず効果がある可能性が高い。そうした臓器横断的治療薬として日本で最初に承認されたのは、免疫チェックポイント阻害薬キイトルーダ(一般名ペムブロリズマブ)で、*高頻度マイクロサテライト不安定性(MSI-High)陽性の固形がんに対し、2018年12月に承認された。
*高頻度マイクロサテライト不安定性=マイクロサテライトとはDNAに散在する1~数個から成る塩基配列の繰り返しのこと。DNAは複製時にエラーが生じることがあるが、通常ミスマッチ修復機能(MMR)により修復される。MMR機能が欠損しているとエラーが修復されず、異常な回数の反復を行うことがある(マイクロサテライト不安定性)。これが高頻度に起こるとDNAエラーが修復されず、がん化する
経口薬で液剤も、より選択的に効いて副作用も許容範囲内
「世界的にはヴァイトラックビ (一般名ラロトレクチニブ)のほうがTRK阻害薬の先発薬で、2018年に米国で、2019年に欧州で承認されています。NTRK融合遺伝子陽性の固形がんにはこの薬剤が世界的な標準治療の1つといえます」と、聖マリアンナ医科大学病院腫瘍内科部長で同腫瘍センター長の砂川優さん。
では、ヴァイトラックビとはどんな薬か、見てみよう。
承認のもとになったのは「NAVIGATE試験」と「SCOUT試験」。 NAVIGATE試験は12歳以上のNTRK融合遺伝子陽性の進行・再発固形がん患者を対象とした国際共同第Ⅱ相試験116例(うち日本人3例)の結果、奏効率は65.2%。完全奏効16.9%で、うち1例は手術を受けたのち病理学的完全奏効が確認された。奏効率が高かったのは唾液腺がん(87.5%)、肉腫(78.9%)、非小細胞肺がん(77.8%)、甲状腺がん(68.4%)など。
また、SCOUT試験は21歳以下の進行・再発固形がん患者を対象とした国際共同第Ⅰ/Ⅱ相試験(73例)で、うち第Ⅱ相試験で有効性解析集団としたNTRK融合遺伝子陽性36例の奏効率は88.9%(32/36例)だった。完全奏効は22.2%(8例)で、部分奏効のうち4例と、安定と判定されたうちの1例でも、手術後に病理学的完全奏効が確認されている。奏効率が高かったのは、乳児繊維肉腫(100%)、骨肉腫(100%)、軟部肉腫(72.7%)などとなっている。
「全体として約65%の患者さんに奏効し、腫瘍が30%以上縮小しています。ほとんどの患者さんは標準治療を受けたあと、〝これ以上の治療がない〟状況で参加していると思われるので、10人中7人で30%以上腫瘍が縮小するのはすごいことです」(砂川さん)
副作用はNAVIGATE試験では116例中95例(81.9%)に認め、主な副作用は浮動性めまい(27.6%)、*ALT増加(23.3%)、*AST増加(23.3%)、疲労(19.9%)など。SCOUT試験では73例中48例(66%)に認め、主な副作用はALT増加(30%)、AST増加(23%)、好中球減少(22%)など。
「肝機能障害が比較的多いようですが、血液検査で状態を確認していれば、副作用はあまり気にならない薬剤です。それに、ヴァイトラックビはロズリートレクと同じ経口薬ですが、液剤もあります。飲みやすく、扱いやすいのではないかと思います」(砂川さん)
先に承認されたロズリートレクとはどこが違うのだろうか。
「ロズリートレクはNTRK融合遺伝子だけでなく、ALK融合遺伝子、ROS1融合遺伝子などを有するがんにも効果があります。ですからROS1陽性の非小細胞肺がんにも2020年に適応拡大されています。ところが、ヴァイトラックビはTRK融合タンパク質にしか結合しないので、いわばより選択性が高い薬剤といえます」(砂川さん)
ちなみに、がんの遺伝子解析が進んだことにより肺がん、乳がんといった主だったがんの中でも希な遺伝子異常のタイプがあることがわかってきた。「希少フラクション」と呼ばれ、最近は新しいタイプの希少がんとも考えられている。こうした希少がんへのゲノム医療の意味を砂川さんはこう語る。
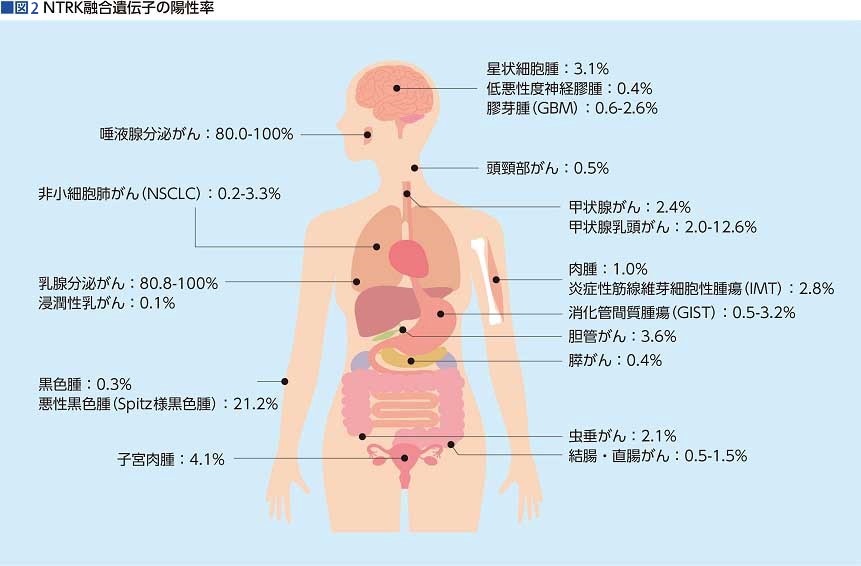
「例えば、NTRK遺伝子が融合を起こしているがんは悪性度が高いといわれています。そうしたがんに高い効果が期待できる薬剤が使えるようになるのは、患者さんに大きな朗報です」(図2)
*ALT、AST=いずれも肝機能障害の指標となる酵素
新たに血液を用いたがん遺伝子パネル検査も登場
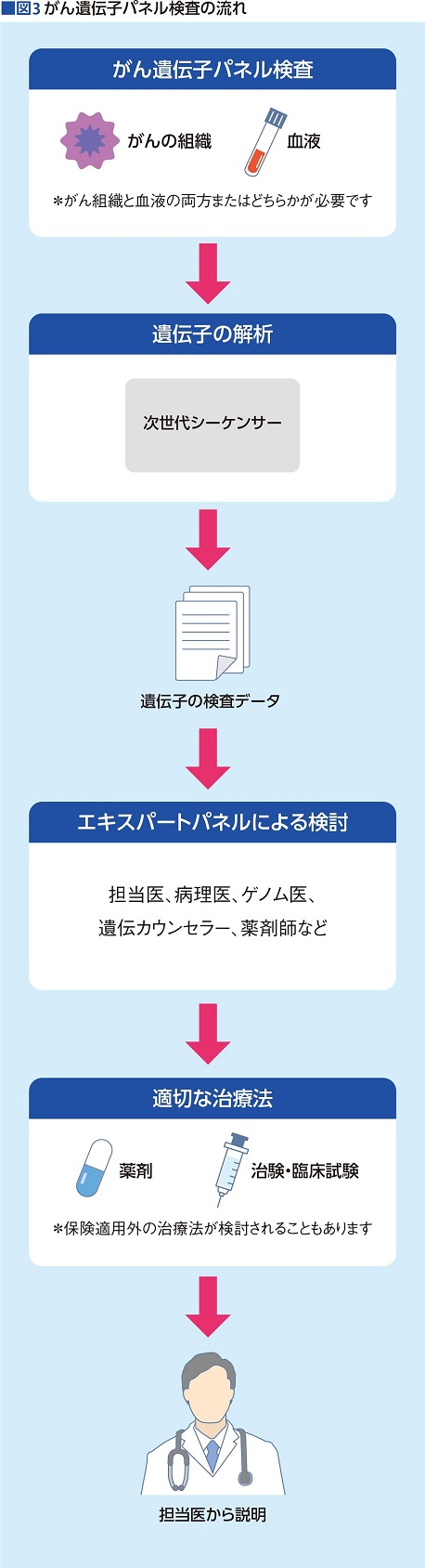
これまでは、分子標的薬の開発とともに、遺伝子検査はEGFR、HER2など単一のがん遺伝子を対象に行われてきた(コンパニオン診断)。しかし、次々と新たながん遺伝子をターゲットにした分子標的薬の登場で、それぞれの薬剤に対するコンパニオン診断が難しくなっていた。そこで登場したのが「包括的ゲノムプロファイリング検査」(CGP)という一度に多くのがん関連遺伝子を調べる検査だ。この検査は、通称「がん遺伝子パネル検査」と呼ばれている(図3)。
現状、日本で承認されている腫瘍組織を用いた遺伝子パネル検査は2つ。米国の「FoundationOne CDx がんゲノムプロファイル」と、国立がん研究センターなどが開発した「OncoGuide NCCオンコパネルシステム」だ。
前者は324のがん遺伝子と、MSI-Highが検査できる。一方、NCCオンコパネルは137の遺伝子で、MSI-Highも検査でき、比較的少量の検体(腫瘍組織)でも検査が可能。
もっとも、NCCオンコパネルでもALK、BRCA、EGFR、NTRK、KRAS、ROS1など、これまでに確認されている代表的な遺伝子異常はほぼ網羅されている。そのため、NCCオンコパネルでも、検査結果を解析する専門家会議(エキスパートパネル)で結論が出たら、FoundationOne CDxをコンパニオン診断とする薬剤であっても投与することができるそうだ。
なお、FoundationOne CDxは、検体の量や取扱いに注意が必要だが、最近、大きな前進があった。2021年8月から、「FoundationOne Liquid CDx」という、血液サンプルを用いた遺伝子パネル検査(リキッドバイオプシー検査)が保険適用されたのだ。
「手術時の腫瘍組織などを用いて遺伝子パネル検査を行う場合、注意すべきなのは、それが患者さんの現在のがんの情報ではない可能性があることです。腫瘍は、再発時に性格が変わっている可能性がありますし、抗がん薬治療などで性格が変わる可能性もあります。その点、リキッドバイオプシー検査は、患者さんの負担も少なく、現在のがんの状態が評価できるのが最大の利点です。ただ、体内の腫瘍量が少ないと検出できない場合もあるので、どの方法で行うかは患者さん毎に医療者が慎重に選択しています」(砂川さん)
同じカテゴリーの最新記事
- 新薬や免疫チェックポイント阻害薬も1次治療から 胃がんと診断されたらまずMSI検査を!
- リムパーザとザイティガの併用療法が承認 BRCA遺伝子変異陽性の転移性去勢抵抗性前立腺がん
- 免疫チェックポイント阻害薬で治療中、命に関わることもある副作用の心筋炎に注意を!
- SONIA試験の結果でもCDK4/6阻害薬はやはり1次治療から ホルモン陽性HER2陰性の進行・再発乳がん
- dose-denseTC療法も再脚光を ICI併用療法やADC新薬に期待の卵巣がん
- 心不全などの心血管の副作用に気をつけよう! 乳がんによく使われる抗がん薬
- 新規薬剤の登場でこれまでのサブタイプ別治療が劇的変化! 乳がん薬物療法の最新基礎知識
- 世界最大規模の画期的研究の一部解析結果が発表 大腸がんの術後補助療法の必要性をctDNAで判断する
- 「過剰検査・過剰治療の抑制」と「薬物療法の進歩」 甲状腺がん治療で知っておきたい2つのこと
- 薬物療法は術前か、それとも術後か 切除可能な非小細胞肺がん



