乳がん治療にも免疫チェックポイント阻害薬が登場! トリプルネガティブ乳がんで承認、さらに――

乳がん治療にも、ようやく免疫チェックポイント阻害薬が見えてきた。現時点で承認されているのは進行・再発トリプルネガティブ乳がんに対するテセントリク(一般名アテゾリズマブ)のみだが、現在、早期トリプルネガティブ、さらにはホルモン受容体陽性、HER2陽性など他のタイプへの適応を見据えた臨床試験も進められている。
がん研有明病院乳腺内科副医長の尾崎由記範さんに、乳がんに対する免疫チェックポイント阻害薬治療の現状と今後の展望について聞いた。
乳がんではなぜ開発が遅れたのか
2014年、日本で初めて免疫チェックポイント阻害薬オプジーボ(一般名ニボルマブ)がメラノーマ(悪性黒色腫)に承認された。肺がんや腎がんではオプジーボに始まり、キイトルーダ(同ペムブロリズマブ)、テセントリク(同アテゾリズマブ)など免疫チェックポイント阻害薬の開発が大きく進んだ。それらに比べると、乳がんは後れを取ってきたと言わざるを得ない。
その理由について、がん研有明病院乳腺内科副医長の尾崎由記範さんはこう指摘する。
「免疫チェックポイント阻害薬開発の歴史を振り返ると、当初、効果を調べる早期臨床試験で、メラノーマ、腎がん、肺がんなどが上位を占める中、乳がんは上位には挙がってきませんでした。その理由として考えられるのが、メラノーマや肺がんと比べて乳がんは、遺伝子変異の量(遺伝子に起きた傷が修復されずに残り蓄積したもの、その量:Tumor mutation burden)が少ないことがあったと思います」
遺伝子変異の多いがん細胞ほど、がん細胞の表面に出現するネオアンチゲン(遺伝子変異により新たに出現したがん抗原)が多く、それがリンパ球などの免疫細胞による免疫反応を活性化するため、免疫チェックポイント阻害薬の効果が得られやすいと考えられる。つまり、遺伝子の変異が多いがん種に、優先的に免疫チェックポイント阻害薬の開発が進められてきたというわけだ。
ところがここ2年ほどの間に、トリプルネガティブ乳がんに関して、免疫チェックポイント阻害薬の臨床試験が多く行われ、結果を出し始めていると言う。
「これまでも、乳がんに対する免疫チェックポイント阻害薬の開発が行われていなかったわけではありません。スピード感はありませんでしたが着実に進んでいて、その中で、乳がんではトリプルネガティブが他のタイプに比べて遺伝子変異が多いこと、そしてリンパ球浸潤の頻度が高いことがわかり、それに伴ってPD-L1陽性の割合が高いことがわかってきたのです」
リンパ球浸潤とは、リンパ球ががん細胞を殺すために、直接がん細胞の中に入り込んでくることで、その頻度がトリプルネガティブは高いというのだ。遺伝子変異の多さに加えてリンパ球浸潤の頻度も高いことから、乳がんではまず、トリプルネガティブ乳がんでの免疫チェックポイント阻害薬の開発がスタートしたというわけだ。
ちなみに、トリプルネガティブ乳がんは乳がん全体の15%を占める。ホルモン受容体、HER2ともに陰性のため、これまではホルモン療法も分子標的薬も適応されず、かつ進行も早いため難治とされてきたタイプだ。
進行・再発トリプルネガティブ乳がんで先陣切って
まず結果を出したのが進行・再発トリプルネガティブ乳がんに対するテセントリク併用の臨床試験だった。
転移性または切除不能な進行トリプルネガティブ乳がんに対し、テセントリク+アブラキサン(一般名nabパクリタキセル)併用群とプラセボ+アブラキサン併用群を比較した第Ⅲ相試験「IMpassion130試験」で、無増悪生存期間(PFS)、全生存期間(OS)ともにテセントリク併用群の有用性が認められた(図1)。

これを受けて、2019年9月に乳がんで初めて、進行・再発、かつPD-L1陽性のトリプルネガティブ乳がんに対し、テセントリクが承認されている。
また現在、キイトルーダ+化学療法[タキソール(一般名パクリタキセル)orアブラキサンorジェムザール(同ゲムシタビン)・カルボプラチン]併用とプラセボ+化学療法(同)併用を比較した第Ⅲ相試験「KEYNOTE-355試験」が進行中。現時点で、すでに無増悪生存期間の結果が出ており、昨年(2020年)の米国臨床腫瘍学会(ASCO2020)で発表された。
それによると、切除不能あるいは再発・転移トリプルネガティブ乳がん患者、かつPD-L1陽性群(CPS10以上)における無増悪生存期間中央値がキイトルーダ併用群9.7カ月 vs. プラセボ併用群5.6カ月で、キイトルーダ併用群の有効性が確認された(図1)。
有害事象に大きな差はなく、免疫関連有害事象に限るとキイトルーダ併用群5.2% vs. プラセボ群0%とのことだった。
「この結果を受けて、日本でもキイトルーダ併用を承認する動きが始まっています。ただし、全生存期間のデータがまだ出ていないので、今すぐというわけにはいかないでしょう。その結果を持って承認の方向に進むと思われます。早ければ来年中に承認される可能性はあるのではないでしょうか」
キイトルーダが承認されれば、進行・再発トリプルネガティブ乳がんに対する免疫チェックポイント阻害薬が2剤になる。これは大きな進歩だろう。
早期トリプルネガティブ乳がんの術前治療として
現在、早期トリプルネガティブ乳がん(ステージⅡ~Ⅲ)の術前治療として、免疫チェックポイント阻害薬併用の臨床試験も進んでいる。
昨年(2020年)の欧州臨床腫瘍学会議(ESMO2020)で発表されたのは、術前治療としてテセントリク+アブラキサン併用を12週間投与後、テセントリク+化学療法[アドリアシン(一般名ドキソルビシン)+エンドキサン(同シクロホスファミド)]を8週間投与し、その後、手術を行うものと、テセントリクをプラセボに変えたものとを比較した第Ⅲ相試験「IMpassion031試験」。
結果は、術後の病理学的完全奏効(pCR)がテセントリク群57.6% vs. プラセボ群 41.1%と、テセントリク群が16.5%も上乗せされた(図2)。
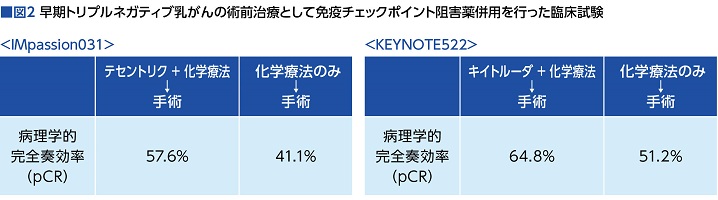
特記すべきは、この上乗せ効果は、PD-L1発現の有無に関わらず見られたことだった。
「IMpassion031試験」試験に先駆けること1年前、ESMO2019で発表された試験結果もある。
早期トリプルネガティブ乳がんの術前治療として、キイトルーダ+化学療法[カルボプラチン+タキソール(一般名パクリタキセル)]併用を4サイクル投与後、キイトルーダ+化学療法[アドリアシンまたはファルモルビシン(同エピルビシン)+エンドキサン]併用を4サイクル行ってから手術をするものと、キイトルーダをプラセボに変えたものとを比較した「KEYNOTE-522試験」だ。
併用した化学療法は「IMpassion031試験」と異なるものだったが、結果は「IMpassion031試験」と同様、キイトルーダ群に15%前後の上乗せ効果が示された。こちらも、PD-L1発現の有無に関わらず、同等の結果だった(図2)。
2年連続、かつ違う薬剤で、早期トリプルネガティブ乳がんの術前治療としての免疫チェックポイント阻害薬併用の効果が示されたとなれば、今すぐにも承認されるのではないかと期待してしまうところだが……。
「米国食品医薬品局(FDA)では『KEYNOTE-522試験』の結果を受けて、既に承認の申請に入っていますが、日本では『KEYNOTE-522試験』『IMpassion031試験』ともに、病理学的完全奏効(pCR)は良い結果が出てクリアしたものの、無イベント生存期間(EFS)が追跡中でまだデータが出ていません。それが出ないと日本では承認されないはずなので、承認には1~2年はかかるのではないかと思います」
とはいえ、追跡中の経過は順調とのこと。このままいけば、近い将来、早期トリプルネガティブ乳がんの術前治療に免疫チェックポイント阻害薬が登場するだろう。これは乳がん治療全体においても大きな流れになることは間違いなさそうだ。
同じカテゴリーの最新記事
- BRCA遺伝子変異の再発乳がんに大きな選択肢が トリプルネガティブ乳がんにリムパーザに続き新たな治療薬が承認予定
- 遺伝子解析でさらに踏み込んだ治療へ トリプルネガティブ乳がんへの挑戦
- トリプルネガティブ乳がんに、PARP阻害薬、PD-1阻害薬などの新薬も登場
- トリプルネガティブ乳がん:新薬、治療内容の開発も盛んに行われている トリプルネガティブでも抗がん薬で半数に効果あり
- サンアントニオ乳がんシンポジウム2012最新報告:新薬、ホルモン療法の最新知見も トリプルネガティブ乳がんにも標的治療実現の兆しが!!
- 術前化学療法で3~5割の患者さんのがんが消えている! 新たな選択肢も!最新トリプルネガティブ治療
- アンスラサイクリン系とタキサン系抗がん剤を上手く使った術前・術後治療がカギ 治療に希望が。トリプルネガティブ乳がん最新情報
- まだ標準治療薬こそないが、アンスラサイクリン系やタキサン系薬剤などが効果的 トリプルネガティブ乳がん患者よ! 術前化学療法で乗り切ろう
- 基本は抗がん剤治療。アバスチンなど新たな分子標的薬が有効とのデータも 決してあきらめないで。トリプルネガティブ乳がんの最新治療



