受ける臨床試験の目的、意味を理解することが重要
だれでもわかる臨床試験データの見方・読み方

癌研有明病院化学療法科・
血液腫瘍科部長の
畠清彦さん
試験の種類によって読み方も違う
新しい薬剤について検討する臨床試験にはいくつかの種類があり、それぞれ目的も違えば結果の読み方も違う、と畠さんは語る。
「第1相試験は、動物の試験や試験管内のデータにもとづいて、人間に安全である使用量を決めるための試験です。したがって有効性を見るのは2次的なことで、もっとも重要なのは毒性、安全性を見ることです」
だいたい3人の被験者を1チームにして薬剤を投与するが、動物の試験のときの量に比べて約10分の1以下の絶対安全な量からスタートして、投与量を増やしていく。副作用を評価するゼロ~5までのグレードがあり、5は「死亡」であり、3以上の非血液毒性、または4以上の血液毒性などが出ると、それ以上の試験を続けることは難しくなる。許容できるもっとも多い投与量が最大許用量(MTD)で、それより1ランク下の安全域の量を推奨用量(RD)と呼んでいる。このような第1相試験は、白血病を除いて、がんの種類にこだわらずにさまざまながん患者を混在させて行うのが一般的だ。
「次に第2相試験は、第1相試験のときにたまたま選んだがんの中で効いた人がいた場合、このがんには効くかもしれないということで試験を組み立てます。第1相は3人の倍数で試験を終わりますが、第2相は一般には数10例を対象に行います。その結果、奏効率(response rate)が20パーセント以上であれば、単独の治療薬として有効な薬剤(効く薬)ということになり、ほかのがんについても検討することになります」
奏効率はCR(病変が消失)+PR(病変が50パーセント縮小)で示されるが、20パーセントというと低い数字に思うかもしれない。しかし、臨床試験の対象となるのは普通、今まで他の治療を受けて効果のみられない患者。すでにほかの薬剤で効果が認められた患者は除かれているので、これらの患者と合わせれば、奏効率は全体としてはもっと高い数字になるはずだ。
さらに100人以上の患者を対象に有効性・安全性を検証するのが第3相試験。通常、行われるのは試験薬剤を投与する群とプラセボ(治療効果のある成分が入っていない薬、「偽薬」「擬薬」などと訳される)を投与する群に分け、だれが試験薬剤でだれがプラセボになるかわからないようにするため、くじを引いて行うランダム化比較試験だ。
| 0 | 1 | 2 | 3 | 4 | |
|---|---|---|---|---|---|
| 白血球 (×10/μl) | 3.3-8.8 | <3.3-3.0 | ≧2.0-<3.0 | ≧1.0-<2.0 | <1.0 |
| 血小板 (×10/μl) | 130-350 | <130-75 | ≧50-<75 | ≧10-<50 | <1.0 |
| ヘモグロビン (g/dl) | 13.5-17.5 | <13.5-10.0 | 8.0-<10.0 | 6.5-<8.0 | <6.5 |
| 嘔吐 | なし | 治療前に比べ、1日当たり1回多い | 治療前に比べ、1日当たり2~5回多い | 治療前に比べ、1日当たり6回以上多い。または静注補液が必要 | 集中治療を要する生理機能状態 |
| 下痢 | なし | 治療前に比べ、<4回/日の排便回数増加 | 治療前に比べ、4~6回/日の排便回数増加、または夜間排便 | 治療前に比べ、≧7回/日の排便回数増加、または失禁、脱水に対する輸液を必要とする | 集中治療を要する生理機能状態、または循環動態の虚脱 |
| 脱毛 | なし | 軽度(枕につく) | 著しい脱毛 | ― | ― |
性別やステージ、投与方法もチェック
具体的に、試験結果を吟味するチェックポイントとしてはどこを見たらいいのだろうか。
まず、どんな患者を登録したのかという登録基準がどうなっているか、その一方で、こういう患者は入れられないという除外基準、年齢、性別、どんな治療を行うかの方法論(たとえばランダム化比較試験なのか、そうでないのか)などがあり、プライマリーエンドポイント(主要評価項目、primary endpoint)も重要だ。
「プライマリーエンドポイントとは、要するに何を解析するのかということです。効果があったかどうかを見るのか、副作用が少なくなったというのを見るのか、あるいは生存期間といって、寿命が長くなったか短くなったのかを見るのか、それとも、再発の率が少なくなったのを見るのか、全部をあわせてみるのか、というようなことで、どれを見るかで目標も違ってきます」
年齢については、日本では、同意書の問題もあって20歳以上となっていて、高齢になるほど個人差も大きくなるので、75歳までを対象としていることが多い。また、年齢が高いか低いかで成績が違う場合があるので、70歳以上かそれ以下かで、解析するときに分けることもあるという。
被験者の性別も解析する上でのポイントの1つ。女性に効く薬が男性には効きにくいケースがあり、たとえば、イレッサは女性が圧倒的に効きやすいという報告がある。ホルモン療法でも男女差があるし、男性のがんと女性のがんでは効く薬剤が違うことがある。
試験結果には、被験者の全身状態がどうなっているかを示すパフォーマンスステータス(PS)も記載されている。5段階に分かれていて、ゼロは普通の生活ができる人、5は寝たきりの人をさす。できればPSがゼロ~1の元気な人、悪くても2までの人が臨床試験の対象となるのが普通だ。
| 0 | 無症状で社会活動ができ、制限を受けることなく発病前と同等にふるまえる |
| 1 | 軽度の症状があり、肉体労働は制限を受けるが、歩行や軽労働、(軽い家事など)、座業(事務など)はできる。 |
| 2 | 歩行や身の回りのことはできるが、ときに少し介助がいることもある。軽労働はできないが、日中の50%は起居している。 |
| 3 | 身の回りのある程度のことはできるが、しばしば介助が必要で、日中の50%以上は就床している。 |
| 4 | 身の回りのこともできず、つねに介助が必要で、終日就床を必要としている。 |
「それから、病気がどこまで広がっているかのステージが書かれてあります。全身転移があるのは4、局所にとどまっているのは1ですが、これも病気の範囲が小さい人ほど効きやすいという傾向があり、大きいほど効きにくい。また、リンパ節転移の数が多ければ多いほど効きにくいし、少なければ少ないほどタチがいい。そういう人がどれくらいいたか、あとで解析するときに必要になるので、データとして読む必要があります」
薬の投与方法も書かれてある。点滴なのか飲み薬なのか、週に1回投与するのか、2週間あるいは3週間に1回なのか。これを投与間隔といっているが、投与間隔が短ければ短いほど強い治療ということになり、1週間に1回やるほうが3週間に1回より3倍強いことになる。
最近よく使われるRECIST基準
「それらを読んだあとに、いよいよ成績ということになります。臨床試験の結果を読むにあたっては、奏効率といって、臨床の反応の判定をする用語があります。いちばんよく効いたのはCRで、これは病気が消えてしまった、転移があったのが消えてしまったことをさします。ただし、消えたかどうかを見るためには、消える前の病変を判定しないといけません。
一般には、MRIやCTで1センチ以上の病変を判定しますが、これを評価病変と呼んでいます。なぜ1センチ以上かというと、CTの原理を考えると5~7ミリ間隔で撮影するので、7ミリとか5ミリだと写らないことがある。そこで1センチ以上を評価病変として、個数を数えます。長径と短径を数えて、その合計を足したものが、治療したあとにどれくらい小さくなったかということで判断します。これをRECIST(レシスト)基準といって、最近使われているのがこの基準です」
1センチ以上の病変がいくつあるか、大きい順に5個とか4個とか選んで評価していく。その評価の基準としては、CRは病変が完全に消えた場合、PRは50パーセント以上減った場合、SDはほとんど変化がないかプラスマイナス25パーセント前後の変化の場合、PDはプラス25パーセント以上に変化した場合、つまり悪くなった場合。PDなら試験は中止。CRかPRなら、それがいつまで続くかが問題となる。奏効はしたので、奏効期間(duration of response)が長ければ長いほどいい治療ということになる。奏効期間が長ければQOL(生活の質)がよくなるし、長生きすることにもなるからだ。つまり、奏効率がよければよいほどよい治療だし、奏効期間が長ければ長いほどよい治療ということになる。
| CR(complete response) | 完全奏効 | すべての病変の100%縮小(消失)が4週間以上持続。 |
| PR(partial response) | 部分奏効 | 病変の50%以上の縮小が4週間以上持続。 |
| SD(stable disease) | 安定 | 病変の縮小率が30%未満または20%以内の増加で、新病変の出現のない状態が4週間以上持続。 |
| PD(progressive disease) | 進行 | 最も縮小した時点から、25%以上の増大または、新病巣の出現。 |
有害事象の判定も欠かせない
「ただし、今、述べたことは、よく効いたかどうかどうかであり、治療の片側を見ていることになります。一方で毒性、有害事象をチェックしないといけません。つまり、いくらよく効いても患者さんが亡くなってしまったのでは何にもなりません。1回目の治療で効果があっても、薬が強すぎて2回目がとてもやれないぐらいになってしまったのではいけない。したがって、副作用のチェックが必要になってきます」
副作用の評価としては、血液学的有害事象と、非血液学的有害事象が問題となる。血液学的有害事象とは、白血球が減ったり血小板が減ったりした場合で、輸血が必要になったり、副作用を抑える薬の投与が必要になるので、試験を続けていくことができなくなってしまう。また、非血液学的有害事象とは、神経のしびれやだるさ、吐き気などがあげられ、これも投与の中止につながる。 副作用は前述したようにゼロから5までのグレードでチェックする。5は死亡で、ゼロなら何もなし。1~2はとくに処置を要さないもの、3~4は点滴をしたりの処置が必要。どのパーセンテージが多いかで、強い治療か、軽い治療かを判定する。
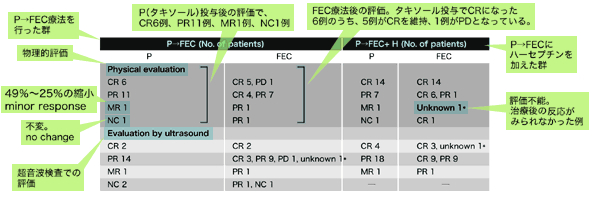
P=タキソール(一般名パクリタキセル)
FEC療法=5-FU(一般名フルオロウラシル)、ファルモルビシン(一般名エピルビシン)、エンドキサン(一般名シクロフォスファミド)の3剤併用療法
P→FEC療法では、タキソール投与後に、FEC療法を行う
H=ハーセプチン(一般名トラスツズマブ)
同じカテゴリーの最新記事
- ビタミンDの驚くべき効果がわかってきた 消化管がん手術後の再発・死亡リスクを大幅に減少
- 乳がんサバイバーの再発恐怖を軽減 スマホアプリの臨床試験で世界初の効果実証
- 国立がん研究センター東病院が取得したCAP認定とは? 国際的な臨床試験が日本でもっと行われるために
- 前がん病変の白板症に注意を! 自分で気づくことができる舌がんは早期発見を
- 臨床試験以上に治療効果が上がっているオプジーボ 再発・転移の頭頸部がんにキイトルーダが承認間近!
- 性の多様化によって中咽頭がんが急増中 HPVが原因の中咽頭がんに気をつけよう!
- 頭頸部がんに対する「光免疫療法」の第Ⅲ相試験開始 第Ⅱ相試験の好結果を受け、早期承認への期待高まる!
- 新たにウイルス療法や免疫チェックポイント阻害薬など 悪性度の高い膠芽腫などの脳腫瘍治療に見えてきた可能性
- 日本初!免疫チェックポイント阻害薬の臓器横断的適応 高頻度マイクロサテライト不安定性(MSI-H)大腸がんにもキイトルーダ承認
- 体重減少・食欲改善の切り札、今年いよいよ国内承認か がん悪液質初の治療薬として期待高まるアナモレリン



