- ホーム >
- 薬 >
- 免疫チェックポイント阻害薬
日本初!免疫チェックポイント阻害薬の臓器横断的適応 高頻度マイクロサテライト不安定性(MSI-H)大腸がんにもキイトルーダ承認

抗腫瘍薬や分子標的薬に効果が乏しいことが多いMSI-H大腸がんに、2018年末、光が射した。免疫チェックポイント阻害薬キイトルーダの承認だ。しかも、大腸がんだけでなく、MSI-Hという遺伝情報にたくさんの変化を起こしている固形がんすべてに承認されたのだ。MSI-Hがんに免疫療法がなぜ有効なのか、そのメカニズムを探った。
がん種を規定しない初の承認
がん罹患数、死亡者数ともに全がん種中、上位に位置する大腸がん。2018年の予測罹患数は、男女併せて15万2,100人と全がん種中トップ。予測死亡数も、5万3,500人と肺がんに次いで2位になる見込みだ。
一方で、大腸がんほど治療法が確立されているがん種もないのではないだろうか。効果的な抗腫瘍薬、分子標的薬が数多く揃っており、手術不能な進行大腸がんでも、治療法の種類は豊富。たとえ1次治療で効果が思うように得られなくても、2次治療、3次治療と、抗腫瘍薬や分子標的薬を変更したり、併用の組み合わせを変えながら治療を続けることができる。
ところが、大腸がんの中には、こうした抗腫瘍薬や分子標的薬にほとんど効果を示さないタイプのものがある。その1つに高頻度マイクロサテライト不安定性(Microsatellite Instability:MSI-high:MSI-H)という特有のゲノム(遺伝情報)の変化を持つ大腸がんがあり、全大腸がん患者のおよそ6%、手術不能なステージⅣの大腸がんの1~3%ほどの割合で起こる。
割合としては小さいのだが、抗腫瘍薬や分子標的薬が効果を示しやすい大腸がんにおいて、MSI-Hの大腸がんは、標準治療である抗腫瘍薬併用療法(*FOLFOX、*FOLFIRI、*FOLFOXIRIレジメンなど)や分子標的薬(*アバスチン、*アービタックス、*ベクティビックス、*サイラムザ、*ザルトラップ)のどれに対しても、さらには、いかに組み合わせようとも、効果が出にくいというのが実情だ。
「*イリノテカンには反応を示すことがありますが、総じて、MSI-H大腸がんは抗腫瘍薬に効果が乏しいことが多い」と埼玉県立がんセンター腫瘍診断・予防科長の赤木究さんは語る。
そこに現れたのが、免疫チェックポイント阻害薬の*キイトルーダ。MSI-H固形がんを対象に行われた2つの国際共同第Ⅱ相試験によって、キイトルーダは、MSI-H大腸がん患者と、大腸がん以外のMSI-H固形がん患者の双方に明らかな効果を示し、その有効性を証明した。
1つは化学療法などの治療歴を持つMSI-Hの大腸がん患者61例を対象にしたKEYNOTE-164試験で、12カ月無増悪率34.3%、全奏効率(ORR)27.9%、病勢コントロール率50.8%という数字を叩きだした。
もう1つは、同じく化学療法などの治療歴のあるMSI-Hの大腸がん以外の固形がん(子宮内膜がん24例、胃がん13例、小腸がん13例、膵がん10例、胆道がん9例、小細胞肺がん3例など20種類のがん)患者94例を対象にしたKEYNOTE-158試験。
こちらも12カ月無増悪率34.4%、全奏効率(ORR)37.2%、病勢コントロール率58.5%という結果。どちらも、化学療法など既存の治療を試みて効果が見られなかった、もしくは再度増悪した患者への試みであり、MSI-H固形がんに対して、いかにキイトルーダの効果が高いかを示したと言ってよいだろう。
この2つの臨床試験結果を受けて、2018年12月、「がん化学療法後に増悪した進行・再発の高頻度マイクロサテライト不安定性(MSI-H)を有する固形がんへのキイトルーダの適応拡大」という日本初の臓器横断的免疫チェックポイント阻害薬承認に至ったわけだ。
そこで今回は、ゲノムに多くの変化を持つMSI-Hについて知るとともに、MSI-H大腸がん(固形がん)に免疫チェックポイント阻害薬がなぜ効果を示すのかについて考えていきたい。
*FOLFOX=エルプラット(一般名オキサリプラチン)+5-FU(一般名フルオロウラシル)系の併用療法 *FOLFIRI=イリノテカン+5-FU系の併用療法 *FOLFOXIRI=5-FU+アイソボリン(一般名レボホリナートカルシウム)+エルプラット+イリノテカンの併用療法 *アバスチン=一般名ベバシズマブ *アービタックス=一般名セツキシマブ *ベクティビックス=一般名パニツムマブ *サイラムザ=一般名ラムシルマブ *ザルトラップ=一般名アフリベルセプトベータ *イリノテカン=商品名カンプト/トポテシン *キイトルーダ=一般名ペムブロリズマブ
遺伝子変異が多いほど免疫治療が効きやすい
MSI-Hについて述べる前に、まずは「免疫チェックポイント阻害薬は、遺伝子に入った傷が多いがんほど効きやすい」ことを押さえておこう。
遺伝子は体内のタンパク質を作るための情報元であり、本来、私たちの体では、正常な遺伝子情報をもとに正常なタンパク質を作っている。ところが、何らかの原因で遺伝子に傷がつき変化を起こすと、その変化した遺伝子をもとにタンパク質が作られるため、本来は体内に存在しないはずの異常なタンパク質になる。免疫細胞はそれを異物と見なして攻撃し、異常なタンパク質を作っている細胞は消滅する。実際に、我々の体内では毎日、5,000個ほどのがん細胞が作られ、免疫の働きによって消えているという。
遺伝子変異によって作られた異常タンパクは、がん細胞にだけ存在するので、「がん抗原」になりうる。それが目印となって、免疫細胞が異物と認識し排除するわけだ。
ところが、「がん細胞は、免疫の攻撃から逃れるために、PD-L1(PD-1のリガンド)というタンパクを自身の表面に出しているのです」と赤木さん。これこそが、昨年(2018年)、京都大学高等研究院の本庶佑さんがノーベル賞を受賞したことで広く知られるようになったPD-1(受容体)とPD-L1の結合によって、がん細胞が免疫からの攻撃を回避するシステムだ。
がん細胞はPD-L1というタンパク質を出して、免疫細胞のPD-1と結合することで、免疫細胞の攻撃にブレーキをかけていることがわかったのだ。ならば、PD-1とPD-L1が結合しないようブロックしてやればブレーキを解除でき、再び免疫細胞ががん細胞を攻撃し始める。これが免疫チェックポイント阻害薬の作用メカニズムである(図1)。
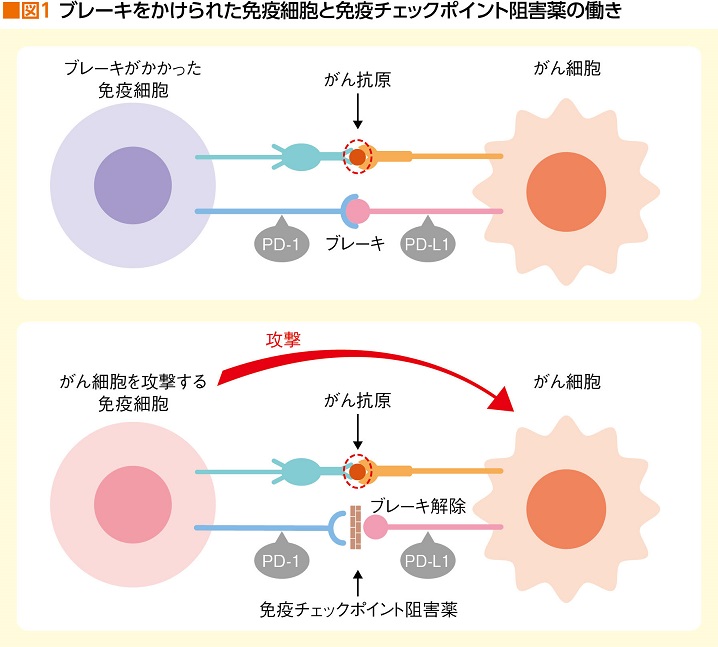
ここで大切なのは、免疫チェックポイント阻害薬が効果を現わす条件として、「免疫細胞は攻撃したいけれど、がん細胞によってブレーキをかけられている状態である」ということだ。
「遺伝子変異によって産生された異常タンパク、つまり、がん抗原が表出していなければ、PD-L1とPD-1が結合して免疫作用にブレーキをかけるという現象が起きませんから、ブレーキ解除のための免疫チェックポイント阻害薬を送り込んでも何の意味もないのです」
つまり、がん細胞の表面に攻撃すべき異物(異常タンパク)が出ていなければ、免疫細胞は攻撃自体をしない。逆に言えば、異物がたくさん出ているほど、PD-L1とPD-1の結合をブロックしてブレーキ解除さえすれば、免疫細胞の攻撃力が発揮される。つまり免疫治療が存分に効果を現わす、というわけだ。がんと認識できる異常タンパクが多く存在しているがんほど、言い換えれば、タンパクを作り出す遺伝子に変異が多いがんほど、免疫治療が効きやすいということになる。
ちなみに、免疫チェックポイント阻害薬が最初に承認されたメラノーマ(悪性黒色腫)は、太陽の紫外線によって細胞の遺伝子が傷ついて起きるがん。当然、遺伝子に多くの傷が入っている(図2)。

同じカテゴリーの最新記事
- 免疫チェックポイント阻害薬との併用療法で大きく前進 新たな進行期分類が登場した子宮体がんの現在
- 免疫チェックポイント阻害薬で治療中、命に関わることもある副作用の心筋炎に注意を!
- キイトルーダ登場前の時代との比較データから確認 進行性尿路上皮がんの予後が大幅に延長!
- 肺がんに対する免疫チェックポイント阻害薬の治療効果は腸内細菌が関係!
- 複合がん免疫療法が、がん薬物療法の主力に! 免疫療法の個別化医療を目指す
- 胃がん新ガイドライン「条件付き承認」で増える治療選択 1次治療でオプジーボ承認
- 乳がん治療にも免疫チェックポイント阻害薬が登場! トリプルネガティブ乳がんで承認、さらに――
- 初期治療から免疫チェックポイント阻害薬選択の時代へ 腎細胞がん治療はここまで来た!
- 患者にもわかりやすく明確化された推奨する治療・しない治療 全面改訂された「大腸癌治療ガイドライン」2019年版
- 肺がんⅢ期の化学放射線療法後にイミフィンジが効果 放射線副作用の肺臓炎をいかに抑えるかが重要



