当事者として主体的な選択をするために
「臨床試験を受けませんか」と言われたら
臨床試験ががん患者にとって身近な問題に
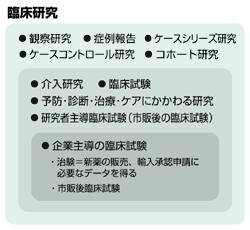
臨床試験とは、新薬の開発をはじめ、他の薬と併せて使う方法や、薬と手術、放射線など他の治療法と組み合わせた治療法の新たな開発と確立を目的とする研究過程において、人間を対象に行われる試験のことである。中でも新たな薬の製造や輸入に際し、厚生労働省の承認と健康保険の適応を得るためのものを治験という。治験も臨床試験の一つにほかならない。
臨床試験は一般のがん患者にとって一見、縁遠いことのように思えるが、がん治療の分野では身近な存在になりつつある。早期がんは別として、進行がんや再発がんの治療法はまだ手探りの段階にあることが少なくない。標準治療法が確立されていなかったり、確立されていても治療効果が乏しかったりする進行がんや再発がんに対しては、これまでと異なる新たな治療法が積極的に試みられ、それが臨床試験の一環として行われるようになってきたことが大きな要因だ。

「実は、日本のがん治療は、つい最近まで個々の大学病院ごとの独自の治療法や、学会の有力教授の推奨や専門医の手前みその治療法が大手をふってきました。医師の個人的知識や経験に頼りすぎ、科学的裏づけの乏しい治療が広く行われてきたことに対して、最近は科学的根拠に基づく医療(EBM)が強く求められるようになりました。その際、がんの治療法の科学的根拠=エビデンスを確認するのに必要不可欠な手段が臨床試験なのです」
と、都立駒込病院血液内科医長の秋山秀樹さんは指摘する。
臨床試験の先進国アメリカ

世界の最先端を切るアメリカのがん治療は、臨床試験の広範な普及・整備によって支えられている。米国国立がん研究センター(NCI)の提供しているデータベース=*PDQ(「がん治療情報」)に見られるように標準治療法と、それ以外の臨床試験中の治療法の二つががん治療の両輪だ。がん患者はまず標準治療を受けることが原則であり、標準治療に代わるオプションとして適切なものがある場合には、臨床試験として治療を受けることが推奨されている。
「アメリカでは標準治療法以外の新たな治療法は、臨床試験として実施されているのが一般的です。がん治療でアメリカが世界の先端を行っているのは、臨床試験によって新たながん治療法のエビデンスの有無が明らかにされ、それを積み重ねてきた膨大な蓄積があるからです」 と日本臨床腫瘍研究グループ(JCOG)のデータセンター長の福田治彦さんは語る。
臨床試験のプロセス
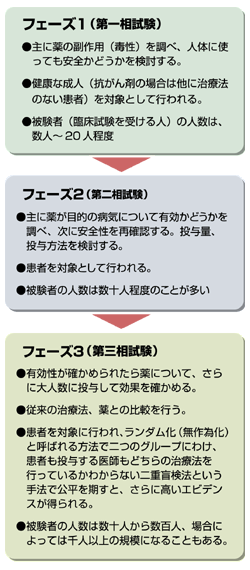
がんの治療法の臨床試験の具体的プロセスを、新規抗がん剤の製造や輸入の際に行われる治験を例にとって見てみよう。
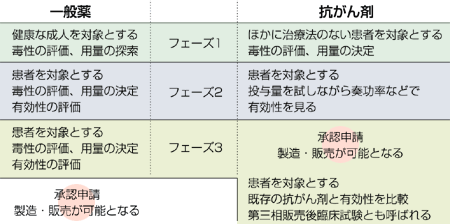
臨床試験はまず第一相試験(フェーズ1)、第二相試験(フェーズ2)、第三相試験(フェーズ3)の三つの段階があり、その関門を順々に一つずつ乗り越えて、初めて厚生労働省から承認を受けられる。
フェーズ1は抗がん剤の効き目よりも、重い副作用が起こらないか、毒性の有無やその強さを調べるのが目的だ。仮に効き目があっても、重篤な障害や死亡を招くことが明らかになったら、その時点で臨床試験はストップする。
「抗がん剤以外の新薬のフェーズ1は、健康な成人を対象に行われます。しかし、抗がん剤のそれは、治療の手だてのなくなったがん患者さんの協力を得て行われます。抗がん剤の毒性がきわめて強いことや、発がん物質であることも少なくないからです」(福田さん)
フェーズ2は抗がん剤の投与量などを試しながら、その有効性を調べるのが目的だ。抗がん剤の有効性は腫瘍の大きさが4週間以上にわたって半分以下に縮小した患者の割合(奏効率)などで判定する。
「抗がん剤以外の新薬はさらにフェーズ3をクリアしなければ承認されませんが、新規抗がん剤はフェーズ2の結果で承認され、製造・販売が可能となります」(秋山さん)
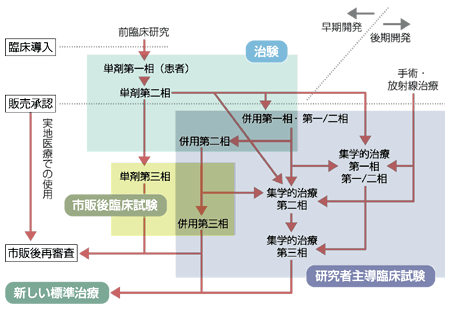
フェーズ3は既存の抗がん剤と比べて効き目が上回るのか、または副作用が少ないのか、あるいはより効果を上げる投与法などの特長の有無を調べるのが目的だ。抗がん剤のフェーズ3は販売後、多くのがん患者へ投与された後に行われるため、第三相市販後臨床試験ともいわれる。
「第三相市販後臨床試験で、既存の抗がん剤と比べ延命効果等の有効性が劣り、新規抗がん剤としてのエビデンスが否定されることもあり得ます」(福田さん)
日本ではフェーズ2をクリアすれば新規抗がん剤として承認されるが、アメリカではケース・バイ・ケースだ。ほとんどはフェーズ3をクリアしないと承認されないが、フェーズ2で承認されることもある。がんが死を目前にすることの多い病気であることと、がん治療に役立つ薬がまだ少ないという事情がその背景にある。
臨床試験はなぜ必要なのか
臨床試験は人間を対象とした実験にほかならないが、それが不可欠なのは最終的に人間=患者を対象とした試験でしか、新薬や新治療法のエビデンスを確認しようがないからだ。もちろん、人工培養された細胞等による実験や動物実験等を繰り返し、治療効果があると確かめられたものだけが臨床試験の対象となるが、最後は人体での実験で治療効果を確認してこそ、初めて普通の病院で一般的に行われる標準治療となり得るのである。
同じカテゴリーの最新記事
- ビタミンDの驚くべき効果がわかってきた 消化管がん手術後の再発・死亡リスクを大幅に減少
- 乳がんサバイバーの再発恐怖を軽減 スマホアプリの臨床試験で世界初の効果実証
- 国立がん研究センター東病院が取得したCAP認定とは? 国際的な臨床試験が日本でもっと行われるために
- 前がん病変の白板症に注意を! 自分で気づくことができる舌がんは早期発見を
- 臨床試験以上に治療効果が上がっているオプジーボ 再発・転移の頭頸部がんにキイトルーダが承認間近!
- 性の多様化によって中咽頭がんが急増中 HPVが原因の中咽頭がんに気をつけよう!
- 頭頸部がんに対する「光免疫療法」の第Ⅲ相試験開始 第Ⅱ相試験の好結果を受け、早期承認への期待高まる!
- 新たにウイルス療法や免疫チェックポイント阻害薬など 悪性度の高い膠芽腫などの脳腫瘍治療に見えてきた可能性
- 日本初!免疫チェックポイント阻害薬の臓器横断的適応 高頻度マイクロサテライト不安定性(MSI-H)大腸がんにもキイトルーダ承認
- 体重減少・食欲改善の切り札、今年いよいよ国内承認か がん悪液質初の治療薬として期待高まるアナモレリン



