安心して臨床試験を受けるための基礎知識
1.臨床試験・治験は必要?

浜松オンコロジーセンター長の
渡辺亨さん
海外で使われる薬の3分の1が使えない

臨床試験とは、治療方法の安全性や有効性を、健常人や患者さんに被験者になってもらって検討するものをいう。臨床試験の中でも、新しく開発された医薬品の製造承認の許可を求めたり、海外で作られた医薬品の輸入の許可を得るための資料を作成するための試験をとくに「治験」と呼ぶ。大切な役割を持つ治験だが、日本には様々な問題があるといわれてきた。
「治験というと、『人体実験だ』『モルモットにされる』というイメージを持っている人がまだまだ少なくありません。それはなぜ治験が必要かということが、十分理解されていないからだと考えられます」
浜松オンコロジーセンター長の渡辺亨さんはこう指摘する。
日本では欧米で使われているがんの治療薬の4分の1強が使えないといわれる。病気に苦しんでいる日本の患者さんに「救いの手」を差し伸べられるかもしれない優れた薬が、外国で使われているのに日本ではしばしば思うように使えないというのが現実だ。
| No. | 成分名 | 対象疾病 | 検討会議での主な検討結果 | 現在の状況等 |
|---|---|---|---|---|
| 1 | オキサリプラチン | 結腸・直腸がん | 承認までの間に安全性確認試験を実施すべき | 平成17年3月18日 承認、 4月6日薬価収載 |
| 2 | ペメトレキセド | 悪性胸膜中皮腫 | 早期に治験が開始されるべき | 承認審査中、 安全性確認試験準備中 |
| 3 | サリドマイド | 多発性骨髄腫 | 早期に治験が開始されるべき | 承認申請準備中 |
| 4 | ボルテゾミブ | 多発性骨髄腫 | 早期の承認申請が行われるべき、 承認までの間に安全性確認試験を実施すべき | 承認審査中、 安全性確認試験実施中 |
| 5 | ベバシズマブ | 転移性結腸・直腸がん | 欧米臨床データ及び国内第1相試験データ等を基に早期に承認申請が行われるべき。申請準備期間中及び審査期間中に安全性確認試験が実施されるべき | 承認審査中、 安全性確認試験実施中 |
| 6 | セツキシマブ | 転移性結腸・直腸がん | 併用療法による第2相試験が早期に開始されるべき | 治験実施中(併用療法第2相試験) |
| 7 | エルロチニブ | 非小細胞肺がん | 進行中の治験状況を注視していくべき | 承認審査中 |
| 8 | テモゾロミド | 悪性神経膠腫 | 国内試験データ(退形成性星細胞腫)及び海外臨床データ(膠芽腫)等を基に早期に承認申請が行われるべき。審査期間中に安全性確認試験(膠芽腫:放射線との併用)が実施されるべき | 平成18年 7月26日承認 |
| 9 | ストレプトゾシン | 膵島細胞がん | 早期に治験が開始されるべき | 治験開始の検討要請中 |
| 10 | イブリツモマブチウキセタン | B細胞性非ホジキンリンパ腫 | 早期に承認申請が行われるべき | 承認審査中 |
| 11 | リポソーマルドキソルビシン | 卵巣がん、 AIDS関連カポジ肉腫 | 早期に承認申請が行われるべき | 承認申請準備中 |
| 12 | クロファラビン | 小児急性リンパ性白血病 | 早期に治験が開始されるべき | 治験開始の検討要請中 |
| 13 | ネララビン | T細胞性急性リンパ芽球性白血病 T細胞性リンパ芽球性リンパ腫 | 早期に治験が開始されるべき | 承認審査中、 安全性確認試験実施中 |
| 14 | ペグアスパラガーゼ | 急性リンパ性白血病 | 早期に治験が開始されるべき | 治験開始の検討要請中 |
| 15 | レナリドミド | 骨髄異形成症候群による貧血 | 早期に治験が開始されるべき。その際には、妊 婦・妊娠可能な女性には使用されないようにす るなど十分に留意すべき | 治験準備中 |
なぜそんなことが起こっているのかというと、とりもなおさず日本では治験や臨床試験がなかなか進まなかったことが挙げられる。それはまず薬の承認に必要な有効性や安全性のデータを集めるための試験の実施体制が、欧米の水準に達していなかったことがある。また、国内の医療機関の治験・臨床試験の「質」が低いという事情や、それに関わる人材不足などの事情もあった。そのため、新薬が使えるようになるまで、日本では外国に比べて飛びぬけて長い時間がかかっていたのだ。
体制はようやく整ってきた
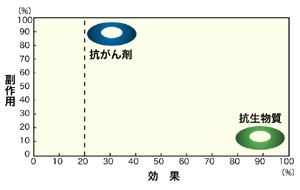
薬は当然のことながら、私たち人間に役立つことを目的に開発されている。したがって、薬の候補となった化合物の有用性を正確に確かめるためには、必ず被験者を作って臨床試験を行われなければならない。人間を対象にして「有効性」と「安全性」が正しく評価されてはじめて「治療薬」となるかどうかがわかる。
とくに抗がん剤の臨床試験はどんな人を対象にしてもよいというわけではなくて、実際にがんになった患者さんを対象に安全性と効果を確認する以外に方法はない。が、抗がん剤では、効果が得られるほどの量が投与されると、必ずといえるほど好ましくない副作用を伴う。そこで、最大の効果を引き出しながら、副作用を最小限に抑えられるような投与量と投与方法も厳密に検討しなければならない。有用性の高い新しい薬剤を導入するためには患者さんの協力が不可欠なのである。


また、すでに海外で使われている医薬品が日
本に新しく導入される場合は、人種の差によって薬の反応が異なるということが起こる。そこで、やはり日本人を対象とした治験が欠かせないのだ。
確かにまだ十分ではないとはいえ、ここ10数年の抗がん剤の進歩と普及は目を見張るものがある。こうした恩恵に浴することができるのも、「将来のために新しい薬の開発に貢献しよう」と、進んで被験者になってきた人たちが貴重なデータを生み出してくれたおかげである。
「よく『日本人が治験に参加したがらないのは、医学の発展に協力しようというボランティア精神が欠如しているからではないか』といわれますが、日本人だけボランティア精神が劣っているわけではありません。いちばんの問題としてはやはり治験のための体制が整っていなかったことであり、そのため人々の認識が不十分だったという事実があると思います。そのなかで『治験をもっと積極的に考えていきましょう』と訴えたいのです」
渡辺さんはこのように呼びかけている。
しかし、最近になって遅れているといわれていた日本の治験を行う体制がようやく整いつつある。大学や医学教育でも治験が学問として認められ、その必要性が説かれるようになっている。CRC(Clinical Research Coordinators=治験コーディネーター)など周辺を支えるスタッフも少しずつだが確実に増えてきた。また、治験に参加する医療施設、製薬会社、医師が守らなければならないGCP(Good Clinical Practice=医薬品の臨床試験の実施の基準の関する省令)というルールも整備されている。
臨床試験を行う医療施設
治験を行う施設は、GCPに定められた次のような要件を満足する病院だけが選ばれる。
- ・医療設備が十分に整っていること
- ・専門の医師、看護師、薬剤師等がそろっていること
- ・治験の内容を審査する委員会を利用できること
- ・緊急の場合には直ちに必要な治療、処置が行えること
同じカテゴリーの最新記事
- ビタミンDの驚くべき効果がわかってきた 消化管がん手術後の再発・死亡リスクを大幅に減少
- 乳がんサバイバーの再発恐怖を軽減 スマホアプリの臨床試験で世界初の効果実証
- 国立がん研究センター東病院が取得したCAP認定とは? 国際的な臨床試験が日本でもっと行われるために
- 前がん病変の白板症に注意を! 自分で気づくことができる舌がんは早期発見を
- 臨床試験以上に治療効果が上がっているオプジーボ 再発・転移の頭頸部がんにキイトルーダが承認間近!
- 性の多様化によって中咽頭がんが急増中 HPVが原因の中咽頭がんに気をつけよう!
- 頭頸部がんに対する「光免疫療法」の第Ⅲ相試験開始 第Ⅱ相試験の好結果を受け、早期承認への期待高まる!
- 新たにウイルス療法や免疫チェックポイント阻害薬など 悪性度の高い膠芽腫などの脳腫瘍治療に見えてきた可能性
- 日本初!免疫チェックポイント阻害薬の臓器横断的適応 高頻度マイクロサテライト不安定性(MSI-H)大腸がんにもキイトルーダ承認
- 体重減少・食欲改善の切り札、今年いよいよ国内承認か がん悪液質初の治療薬として期待高まるアナモレリン



