- ホーム >
- 薬 >
- 免疫チェックポイント阻害薬
肺がんに4つ目の免疫チェックポイント阻害薬「イミフィンジ」登場! これからの肺がん治療は免疫療法が主役になる

2018年末、肺がん治療に対する免疫チェックポイント阻害薬の適応が大幅に拡大された。遺伝子検査で分子標的薬が適応にならなければ、PD-L1発現の有無に関わらず、免疫チェックポイント阻害薬を使った免疫療法を受けられるようになったのだ。2019年の幕開けと同時に、肺がん治療は免疫療法主流の方向に大きく舵を切った――。
治療法が進歩しても手ごわい相手
この15年間で肺がん治療は飛躍的な進歩を遂げた。しかし、今現在もがん死の内訳を見ると、肺がんは男性で1位、女性で2位という状況だ。日本では年間およそ37万人ががんで命を落としているが、その5分の1にあたる約7.4万人が肺がんで亡くなっているという。
「肺がんは早期発見が難しいのです。肺がん検診は通常、胸のレントゲン(X線)検査で行いますが、X線写真では進行した肺がんは見つけられても、Ⅰ期、Ⅱ期といった早期がんはなかなか発見できません」と順天堂大学医学部呼吸器内科学教授の高橋和久さんは指摘する。
CT(コンピュータ断層撮影)なら早期発見できるそうだが、被曝量が非常に高く、機器によっては1枚のCTスキャンでレントゲン100枚分の被曝量があるとも言われている。健康な人が毎年の検診で受けるにはリスクが高すぎることから、CTによる検診は行われない。被曝のないMRI(磁気共鳴画像)についても、「磁気の共鳴によって体内の水分に作用し、その変化を捉えて組織の断層を撮影するというのが、MRIのメカニズムです。そのため、脳など水分で満たされた臓器の撮影には向いていますが、肺は水分ではなく空気で膨らんだ風船のような臓器なので、MRIには不向きです」とのこと。
つまり、肺がんは早期発見が難しく、発見されたときにはⅢ期、もしくはⅣ期の進行がんである場合が多い。最近のデータでは、Ⅰ期もしくはⅡ期の早期がんでの発見が4割、進行がんでの発見が6割とのこと。肺がんは、進行がんとの闘いから始まることが多いため、治療法が格段に進歩した今現在も、手ごわい相手であると言えるだろう。
とはいえ、分子標的薬の登場以降、肺がん治療が目覚ましい進歩を遂げてきたことは周知の事実。2004年に、EGFR遺伝子変異が陽性の場合に*イレッサが効果を発揮することが判明してからは、ALK(アルク)融合遺伝子、ROS1(ロスワン)遺伝子、BRAF(ビーラフ)遺伝子変異と、がん細胞増殖の引き金となる遺伝子変異が次々と突き止められ、それら遺伝子変異のタイプごとに、がん細胞の増殖を食い止める分子標的薬が登場してきた。
昨年(2018年)末には、最も新しいBRAF遺伝子変異を検出できるキット(オンコマインDX)が承認されたばかり。肺がん治療は、患者1人ひとりの遺伝子変異のタイプを見極めて、各々に合った治療を受けられる個別化治療の時代に入っており、現在もその進化は続いている。
さらに新風を巻き起こしたのが、2015年の*オプジーボの登場だ。分子標的薬とは全く違うメカニズム(作用機序)で、がん細胞にアプローチする免疫チェックポイント阻害薬の登場で、肺がん治療は、今まさに、さらに大きく舵を切ろうとしている。
肺がん治療は遺伝子検査から始まる
肺がんは組織型によって「小細胞肺がん(SCLC)」と「非小細胞肺がん(NSCLC)」に分けられ、85%は非小細胞肺がん。さらに非小細胞肺がんは、扁平上皮がん、腺がん、大細胞がんに分けられる。喫煙者に多いのが扁平上皮がん。
40年ほど前までは男性の扁平上皮がんが突出して多かったが、喫煙率が著しく低下した現在は、扁平上皮がんは激減し、最も多いのは腺がんに変わった。肺がん全体の50~60%を腺がんが占めていて、今後、さらにその割合は高くなっていくことが予想されるという(図1)。

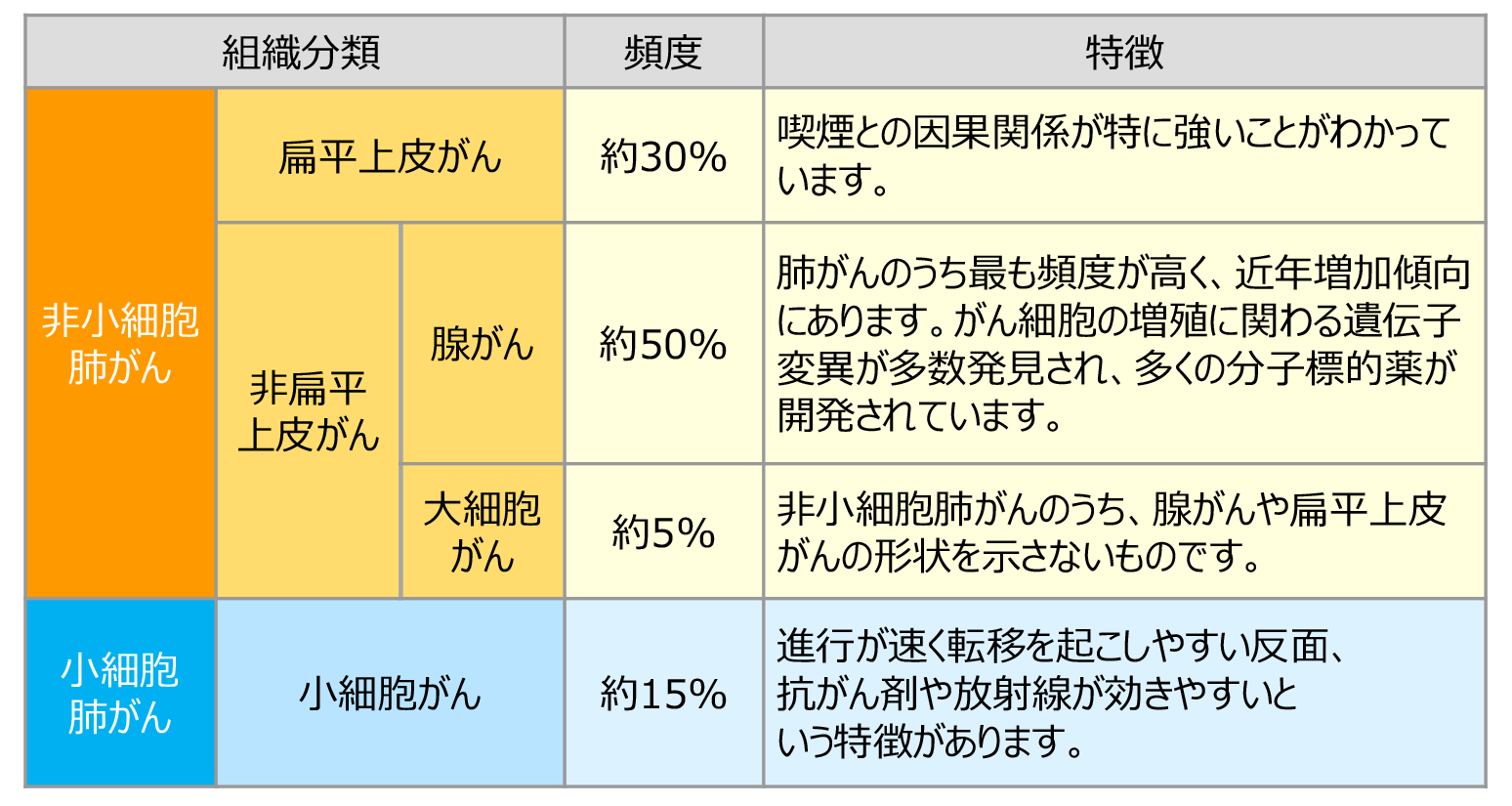
現状で最も罹患率が高く、今後も確実に増えていくことが予想されるため、分子標的薬はすべて、腺がんをターゲットにしているそうだ。ただ、一時的にがんを抑え込んでいるだけなので、いずれは耐性ができて、効かなくなる日がやってくるのが分子標的薬の弱点だ。
耐性と新薬開発の追いかけっこになっている現状に、彗星のごとく登場したのが、2015年のオプジーボに始まる免疫チェックポイント阻害薬。
それでは、肺がんと診断されたら、どのような道順をたどるかを、現時点での最新情報を踏まえつつ追っていこう。
まず、非小細胞肺がんと診断されたら、がん組織を採取して遺伝子検査をし、ドライバー遺伝子変異の有無と種類を見極めるところからスタートする(組織生検)。ちなみに、遺伝子の異常には2通りのパターンがある、と高橋さんは言う。
「遺伝子変異ががん化を積極的に促している場合と、偶然がんになった結果として遺伝子が変異する場合の2通りです。前者をドライバー遺伝子変異、後者をパッセンジャー遺伝子変異と言います。パッセンジャー遺伝子変異はたまたま起きている変異に過ぎないので、そこを阻害しても治療には繋がりません。つまり、遺伝子変異そのものを抑えることでがんを小さくできるのはドライバー遺伝子変異。治療標的として見つけに行くのはドライバー遺伝子変異だけです。それが、EGFR遺伝子変異であり、ALK融合遺伝子、ROS1融合遺伝子、BRAF遺伝子変異ということです」
遺伝子検査でいずれかのドライバー遺伝子変異が陽性と出た場合、その時点で初回治療法(1次治療法)は確定する。最も多いのが、腺がんの約50%を占めるEGFR遺伝子変異。EGFR遺伝子変異のがん細胞に働きかけて、増殖指令の情報(シグナル)伝達物質が結合しないよう遮断するのがEGFR阻害薬(EGFR-TKI:EGFR-チロシンキナーゼインヒビター)で、イレッサ、*タルセバ、*ジオトリフ、*タグリッソがこれに当たる。ALK遺伝子とEML-4遺伝子が途中でちぎれて結合してできたALK融合遺伝子(腺がんの約8%)も際限なくがん細胞を増殖させるシグナルを発信するため、ALK阻害薬(ALK-TKI)の*ザーコリ、*アレセンサ、*ジカディア、*ローブレナ(2018年11月承認)でそのシグナルを遮断する。ROS1融合遺伝子(腺がんの約1%)にはROS1阻害薬(ROS-TKI)のザーコリ、BRAF遺伝子変異(腺がんの約1%)にはBRAF阻害薬(BRAF-TKI)の*タフィンラーと*メキニストの併用療法(2018年3月承認)によって、それぞれ、がん細胞の増殖を抑え込む(図2)。
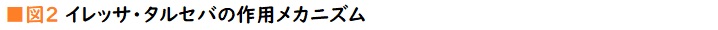
Pollack VA, et al. J Pharmacol Exp Ther 291: 739-48, 1999
遺伝子検査でドライバー遺伝子に陽性が出れば、その変異に対する分子標的薬を最優先に使って治療する。ここまでは従来通り。遺伝子変異検査で陽性が出て、分子標的薬が適用されるのは、腺がんのほぼ半分である。陰性の場合は、以前は化学療法に進むしか道はなかった。そこに、免疫療法(免疫チェックポイント阻害薬)が登場したのは、2016年のことだった。
PD-L1発現1%でも、1次治療からキイトルーダを使えるようになった!
オプジーボは2015年に承認されたが、再発時に限られていたので、1次治療では使えなかった。しかし、2016年に承認された*キイトルーダは、PD-L1の発現が50%以上の場合に限ってだが、1次治療で使えるようになった。そして、昨年(2018年)末、なんと1%でもPD-L1が発現さえしていれば、1次治療からキイトルーダを使えるように適応が拡大されたのだ。
PD-L1とは、がん細胞が持つタンパク分子。免疫細胞であるT細胞が自己免疫疾患に陥らないために攻撃を制御する仕組みとして持つPD-1受容体に働きかけて、T細胞の異物攻撃を止めてしまうという働きを持つ。つまり、がん細胞にPD-L1が50%以上発現しているということは、その時点で、T細胞の作用を止めてしまっている可能性が高いということだ。免疫チェックポイント阻害薬によってT細胞のPD-1受容体にがん細胞のPD-L1が結合しないようにすることで、免疫細胞が活性化して自らの力でがん細胞を再び攻撃し始めることが期待できるというわけだ。
「これまでの1次治療では、PD-L1発現50%以上の高い場合にしかキイトルーダは使えず、たとえ49%発現していても、化学療法しか方法がありませんでした。それが大きく変わって、PD-L1が1%でも発現さえしていれば、1次治療からキイトルーダを使うことができるようになったのです。キイトルーダ単剤はもちろん、キイトルーダと化学療法の併用、もしくは*テセントリクと化学療法の併用に関しても適応拡大になりました。免疫療法の位置づけが、これまでと比べて格段に前面に押し出されたと言ってよいと思います」
さらに特記すべきは、たとえPD-L1の発現が認められなくても(ゼロでも)、キイトルーダと化学療法の併用、もしくはテセントリクと化学療法の併用については、追加承認されたのだ(キイトルーダ単剤については1%以上の発現が必要)。これは何を意味するのだろうか。
「ドライバー遺伝子の変異がなかった場合、これまでは、ほぼ化学療法しか方法がなかったところに、まるごと、免疫チェックポイント阻害薬が入ってきたということです」(図3)
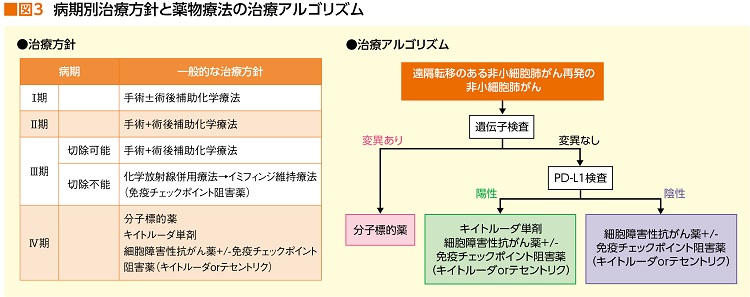
当初、PD-L1の発現が必須条件だった免疫チェックポイント阻害薬だが、免疫細胞のメカニズムはそんなに単純なものではないことがわかってきたのだろう。がん細胞にPD-L1が多く発現していれば免疫チェックポイント阻害薬が効くかというと、必ずしもそうではない。その証拠に、PD-L1発現が50%以上の人でもキイトルーダの奏効率は40%程度。つまり、全く効かない人が半分以上いるということだ。逆に言うと、PD-L1がほとんど発現していなくても効果が見られる場合もあることが、数々の治験で証明され、今回の適応拡大に繋がったというわけだ。
それでは、免疫療法が効きやすいか否かを見極めるバイオマーカー(生物指標化合物)は何かというと、現時点でわかっている一番のバイオマーカーは、やはりPD-L1の発現率だそうだ。ただし、前述のように、PD-L1だけではないことを忘れてはならない。他にも、遺伝子変異の数が多いことも免疫療法が効きやすい条件の1つ。これはEGFR遺伝子変異などのドライバー遺伝子変異があるという意味ではない。あくまでも遺伝子変異の数の多さ、つまり遺伝子の傷の多さがポイントということだ。
「逆に、ドライバー遺伝子変異があると、変異がその1つだけの場合が多いので、免疫療法が効きにくいのです」と高橋さんは指摘する。さらに、宿主(患者)の免疫力の状態として、リンパ球の数も免疫療法の効果に関係するそうだ。リンパ球が多いほうが免疫力が高く、免疫療法も効きやすい。
【分子標的薬/EGFR阻害薬】 *イレッサ=一般名ゲフィチニブ *タルセバ=一般名エルロチニブ *ジオトリフ=一般名アファチニブ *タグリッソ=一般名オシメルチニブ
【分子標的薬/ALK阻害薬】 *ザーコリ=一般名クリゾチニブ *アレセンサ=一般名アレクチニブ *ジカディア=一般名セリチニブ *ローブレナ=一般名ロルナチニブ
【分子標的薬/ROS1阻害薬】 *ザーコリ=一般名クリゾチニブ
【分子標的薬/BRAF阻害薬】 *タフィンラー=一般名ダブラフェニブメシル酸塩 *メキニスト=一般名トラメチニブジメチルスルホキシド付加物
【免疫チェックポイント阻害薬】 *オプジーボ=一般名ニボルマブ *キイトルーダ=一般名ペムブロリズマブ *テセントリク=一般名アテゾリズマブ *イミフィンジ=一般名デュルバルマブ
同じカテゴリーの最新記事
- 免疫チェックポイント阻害薬との併用療法で大きく前進 新たな進行期分類が登場した子宮体がんの現在
- 免疫チェックポイント阻害薬で治療中、命に関わることもある副作用の心筋炎に注意を!
- キイトルーダ登場前の時代との比較データから確認 進行性尿路上皮がんの予後が大幅に延長!
- 肺がんに対する免疫チェックポイント阻害薬の治療効果は腸内細菌が関係!
- 複合がん免疫療法が、がん薬物療法の主力に! 免疫療法の個別化医療を目指す
- 胃がん新ガイドライン「条件付き承認」で増える治療選択 1次治療でオプジーボ承認
- 乳がん治療にも免疫チェックポイント阻害薬が登場! トリプルネガティブ乳がんで承認、さらに――
- 初期治療から免疫チェックポイント阻害薬選択の時代へ 腎細胞がん治療はここまで来た!
- 患者にもわかりやすく明確化された推奨する治療・しない治療 全面改訂された「大腸癌治療ガイドライン」2019年版
- 肺がんⅢ期の化学放射線療法後にイミフィンジが効果 放射線副作用の肺臓炎をいかに抑えるかが重要



